细胞命运调控是衰老再生研究中的重要内容。以往研究发现,异染色质相关蛋白1(Heterochromatin associated protein 1, HP1)作为异染色质的特征性蛋白,能够维持染色体的稳定和调控基因表达,与细胞分化具有重要关系,但是其背后的分子机制尚不明确。 2021年7月,慕尼黑大学Heinrich Leonhardt团队在Nucleic Acids Research(IF=16.97)上发表题为“Phosphorylation of the HP1β hinge region sequesters KAP1 in heterochromatin and promotes the exit from naïve pluripotency”的文章,该研究利用多组学技术(转录组、蛋白质组、泛素化修饰蛋白组学)探讨HP1调控细胞分化的内在分子机制。本研究发现HP1β铰链区的磷酸化能特异性结合并招募多能调控因子KAP1到异染色质,促使细胞原始多能性的退出,是一种转录调节和细胞命运决定的新机制。 【研究材料】 小鼠胚胎干细胞(mESCs)、HEK293T、BHK细胞 【技术方法】 转录组、蛋白质组、泛素化修饰蛋白组学、ChIP-MS等 步骤1:基因突变与互作蛋白组分析揭示HP1β与细胞多能态退出相关 步骤2:生化实验发现CK2a催化HP1β S89磷酸化 步骤3:转录组学分析证实HP1β-pS89促进胚胎干细胞原始多能态的退出 步骤4:IP-MS发现HP1β-pS89的互作蛋白KAP1(泛素E3连接酶) 步骤5:泛素化修饰组学揭示KAP1调控原始多能态退出机制 步骤6:构建HP1β与KAP1调控多能态退出模型进行验证 1. HP1β缺失阻碍多能态退出 为了研究HP1β在mESCs分化中的作用,研究人员构建了HP1β -/-突变mESCs细胞,DPAI染色表明HP1β -/-细胞中染色中心聚集减少,利用ChIP-MS揭示HP1β结合的蛋白参与到染色质区室化和多能性调控过程,进一步利用神经祖细胞分化试验阐明HP1β能够调控细胞多能态退出。 图1 神经细胞分化需要HP1β的参与 2. CK2催化HP1β丝氨酸89号残基的磷酸化 为了研究HP1β在多能性退出中的功能,研究人员在2i/LIF(原始态)和serum/LIF(稳态)培养基中培养mESCs, qPCR结果显示在两种培养条件下HP1β 的表达量没有差异,但是Western Blot结果显示蛋白表达具有差异性,提示翻译后调控的作用。进一步用热敏磷酸酶分析和突变分析,研究人员发现在HP1β丝氨酸89位残基被磷酸化修饰(HP1β-pS89),且该位点是被酪氨酸激酶2(casein kinase 2,CK2a)催化。 在酪氨酸激酶2(casein kinase 2)的结合域之内。进一步利用CRISPR-CA9构建CK2a类似物敏感突变(CK2a1as),加入嘌呤类似物1-NA-PP1之后,发现HP1β-pS89降低,表明CK2a催化HP1β丝氨酸89位残基的磷酸化。 图2 CK2a催化HP1β丝氨酸89位残基的磷酸化 3. HP1β-pS89促进胚胎干细胞原始多能态的退出 研究人员构建了磷酸化突变细胞系HP1β S89A和模拟磷酸化的HP1β S89E、 HP1β S89D突变细胞系。对突变细胞系进行形态学和结构学分析,发现亚稳态培养条件下HP1β S89A和HP1β-/-发现更多的原始态原型菌落。对不同时期突变体进行转录组分析,结果表明HP1β S89A与HP1β S89E以相反的方式影响基因的表达,原始态的多能基因在HP1β S89A和HP1β-/-中明显上调。综上,HP1β pS89是mESCs原始多能态的退出的必要条件。 图3 HP1β S89A促进mESCs原始多能态的退出 4. KAP1调控原始多能性退出机制研究 为了研究HP1β S89A如何影响mESCs原始多能态的退出机制,研究人员在HEK293T细胞中成功表达GFP-HP1β S89D, 利用IP-MS鉴定得到互作蛋白KAP1,结合油滴实验和KAP1突变体实验结果,表明KAP1的CCN结构域能特异性结合HP1β磷酸化位点。对KAP1-/-进行转录组分析,结果表明下调的细胞分化基因与HP1β S89A和HP1β-/-中的情况一致。 前人研究发现KAP1具有泛素E3连接酶的活性,为了探索KAP1在多能维持中的作用机制,研究者对野生型和 KAP1-/-细胞进行泛素化修饰蛋白组学分析,结果表明KAP1通过对异染色质调节因子和转录因子的泛素化来调节多能性。 图4 KAP1依靠其泛素化酶活性来调节多能性 5. KAP1调控多能性退出依赖于HP1β的磷酸化 研究人员利用CHIP-MS在mESCs鉴定原始态到外胚层分化过程中HP1β的结合蛋白,结果显示在外胚层中,HP1β能够与KAP1和其他染色质调控因子互相结合。此外,利用GFP荧光观察到在多能性退出时KAP1向染色中心聚集,并且在HP1β S89E中更加明显,这表明KAP1向染色中心的聚集依赖于HP1β-pS89。综上结果表明,HP1β S89磷酸化特意招募转录调控因子KAP1,共同调控原始多能态的退出。 小结 本研究整合互作蛋白组学、转录组学、蛋白组学和泛素化修饰蛋白组学探讨了异染色质捕获调控因子的分子机理。通过组学分析揭示染色质结合蛋白HP1β参与调控细胞染色质区室形成以及细胞多能态变化,HP1β磷酸化能在异染色质上捕获转录调控因子KAP1,调控细胞分化过程,这种多能性关键调控因子的捕获促进了多能态的退出,揭示了一种远程控制转录调控的新机制。
实验路线图
研究结果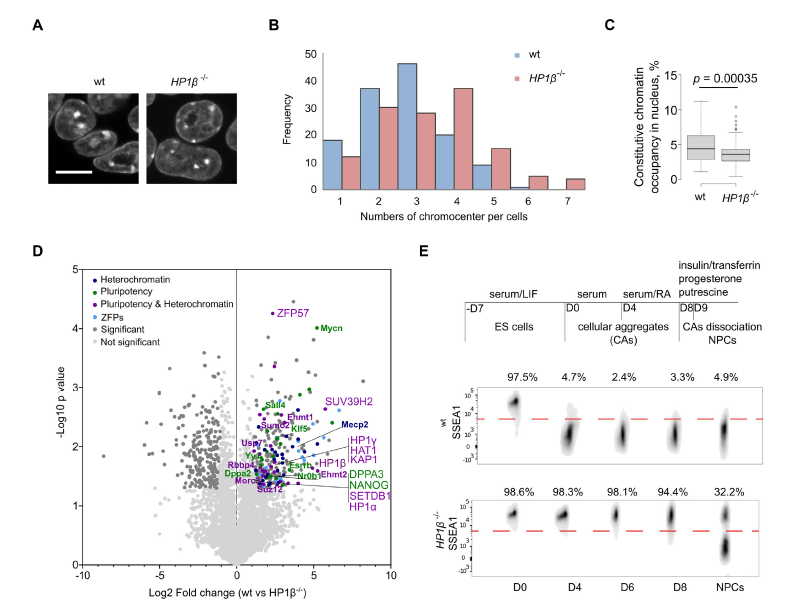
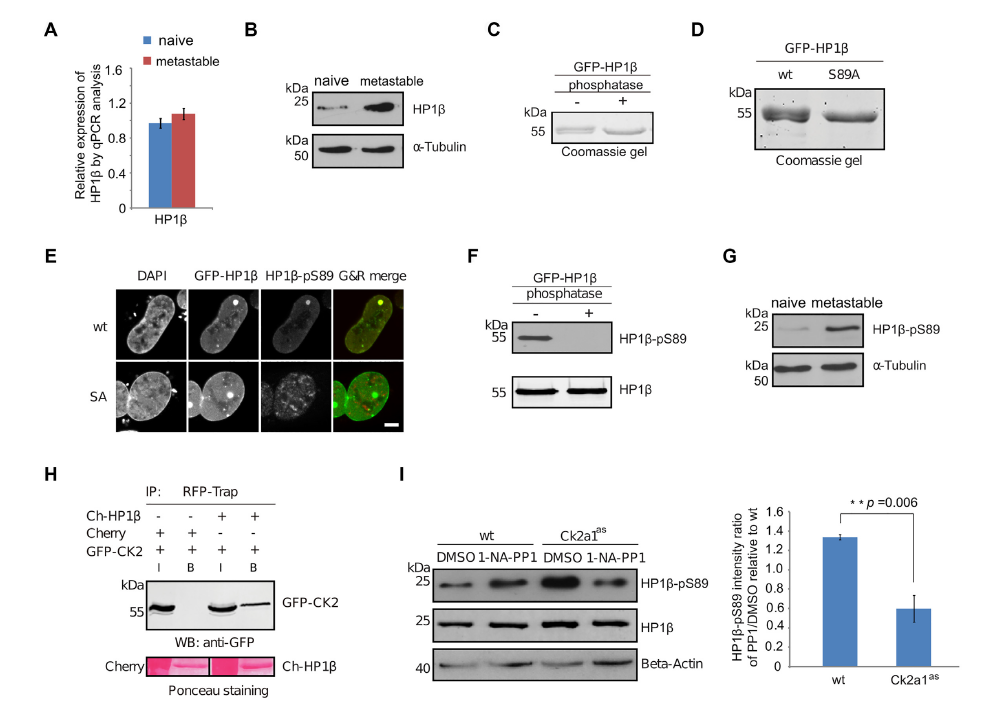
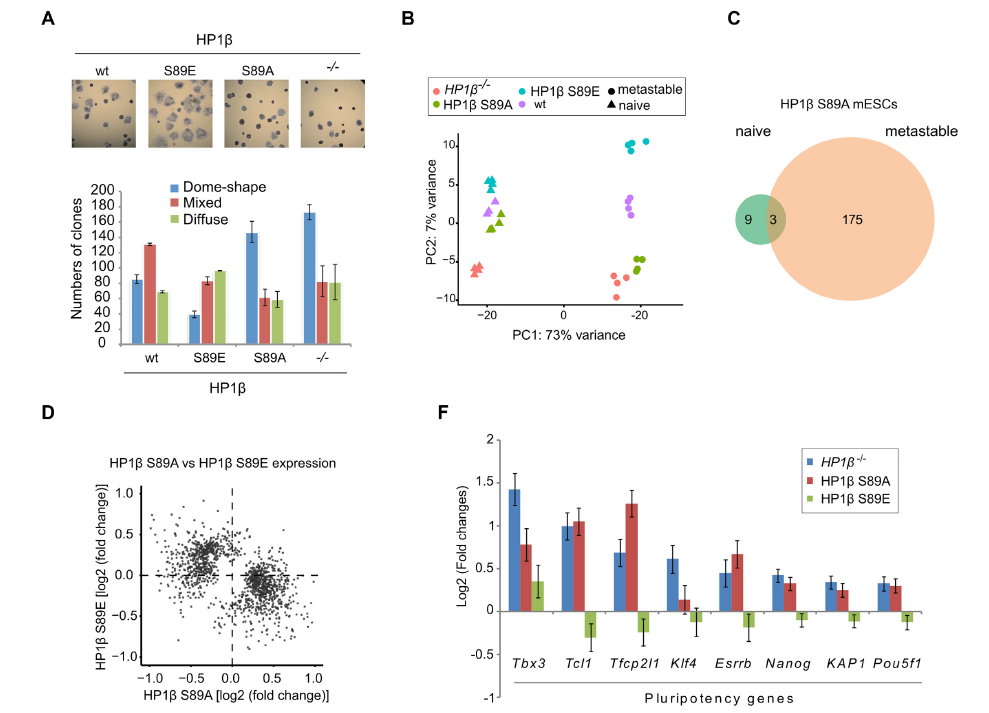
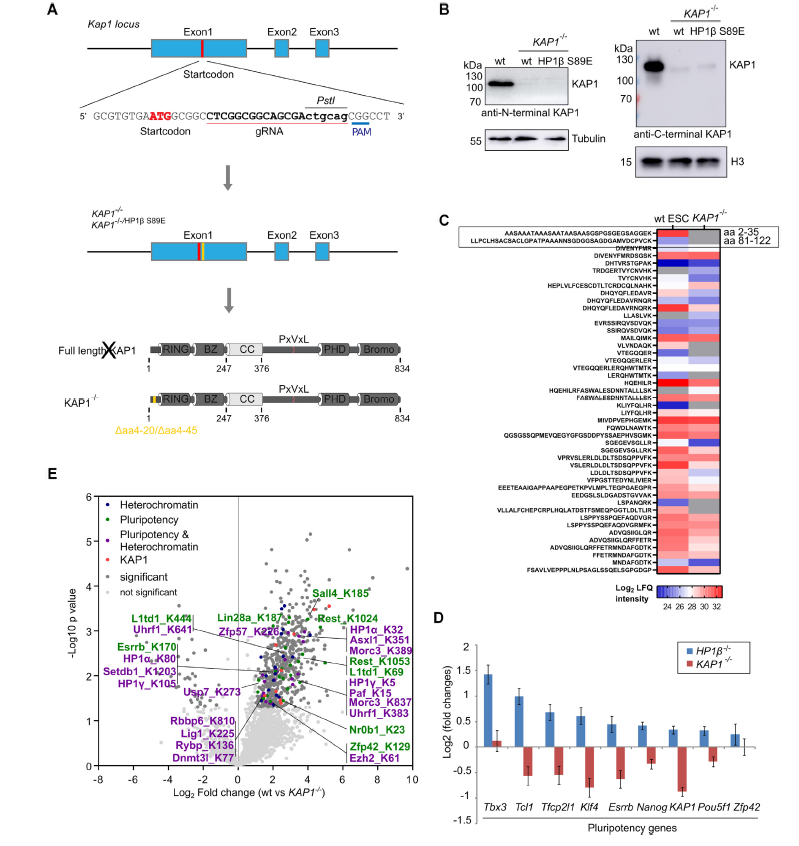
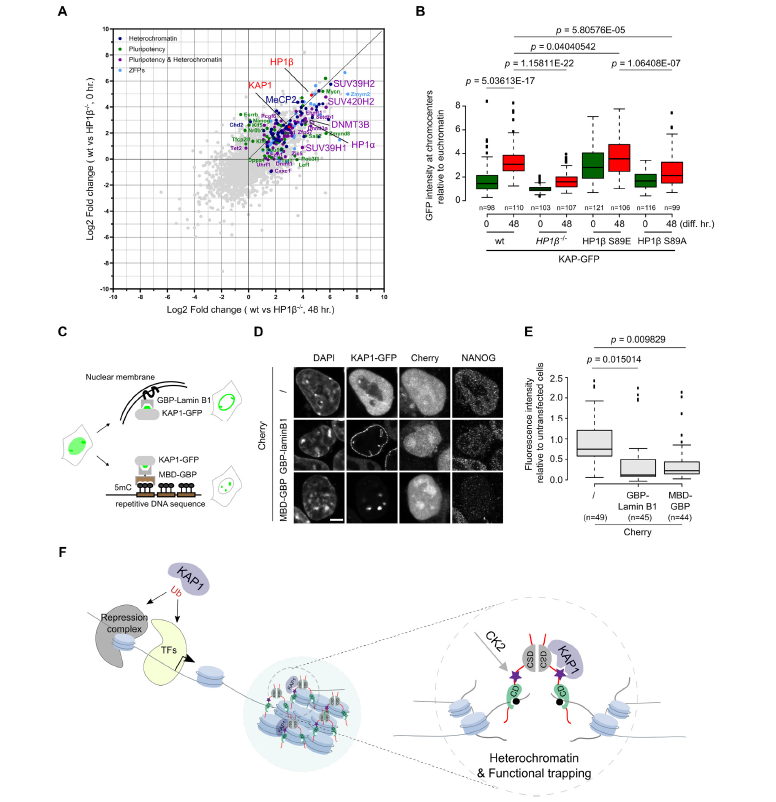
图5 HP1β磷酸化捕获KAP1结合到异染色质上,促进mESCs多能性的退出
中科优品推荐
中科新生命可进行转录组学、蛋白质组学、代谢组学多组学多种技术服务,从多角度、多层次为您提供更专业、更省心的服务。欢迎感兴趣的老师前来咨询。
Nucleic Acids Res(IF 16.97)| 何去何从?多组学助力发现细胞命运调控新机制
作者:上海中科新生命生物科技有限公司 2021-12-23T19:55 (访问量:3684)
上海中科新生命生物科技有限公司 商家主页
地 址: 上海市园美路58号1号楼15-18楼
联系人: 徐
电 话: 021-54665263
传 真:
Email:marketing@aptbiotech.com
相关咨询
会议邀请 | 第8届全国植物蛋白质研究大会暨首届贵阳生命科学新高地科学家论坛 (2023-07-07T14:37 浏览数:23873)
项目文章Cell(IF 64.5)| 中国科技大学探索食物过敏谜团 (2023-07-07T14:22 浏览数:24316)
Gastroenterology(IF 29.4)| 基于机器学习算法开发的外泌体miRNA生物标志物用于胰腺导管腺癌早期诊断 (2023-07-05T15:54 浏览数:22291)
Cancer Letters(IF 9.7)|天津市环湖医院利用Labelfree揭示超声-替莫唑胺联合诱导胶质瘤细胞的凋亡机制 (2023-06-30T09:37 浏览数:23125)
Excel表免费下载 | 速来围观!2023年影响因子发布 (2023-06-29T09:35 浏览数:19862)
外泌体多组学创新解决方案,精准、前沿的疾病诊断生物标志物 (2023-06-28T10:20 浏览数:27149)
Immunity (IF=43.474)丨单细胞+空间联合揭示肉芽肿形成的异常淋巴发育进程 (2023-06-26T17:28 浏览数:22091)
专家齐聚 亮点回顾 | 2023年海口·中医药创新多组学研究论坛圆满落幕 (2023-06-25T10:10 浏览数:26468)
项目文章Plant J(IF 7)| 杭州师范大学王慧中团队通过空间代谢+单细胞测序等揭示红豆杉幼茎细胞特异的紫杉烷合成调控模式 (2023-06-25T09:42 浏览数:24382)
项目文章Gut Microbes(IF 9.434)| 肠道微生物竟是导致胆囊切除术后患者腹泻的元凶? (2023-06-14T16:35 浏览数:21406)
