论文标题:Induction of m6A methylation in adipocyte exosomal LncRNAs mediates myeloma drug resistance
刊登日期:2022年01月
发表杂志:Journal of Experimental & Clinical Cancer Research
影响因子:12.658
研究机构:休斯顿卫理公会癌症中心,休斯顿卫理公会研究所,厦门大学医学院癌症研究中心,德克萨斯大学安德森癌症中心血液学系
技术手段:m6A测序、联川生物OmicStudio云平台
文章架构
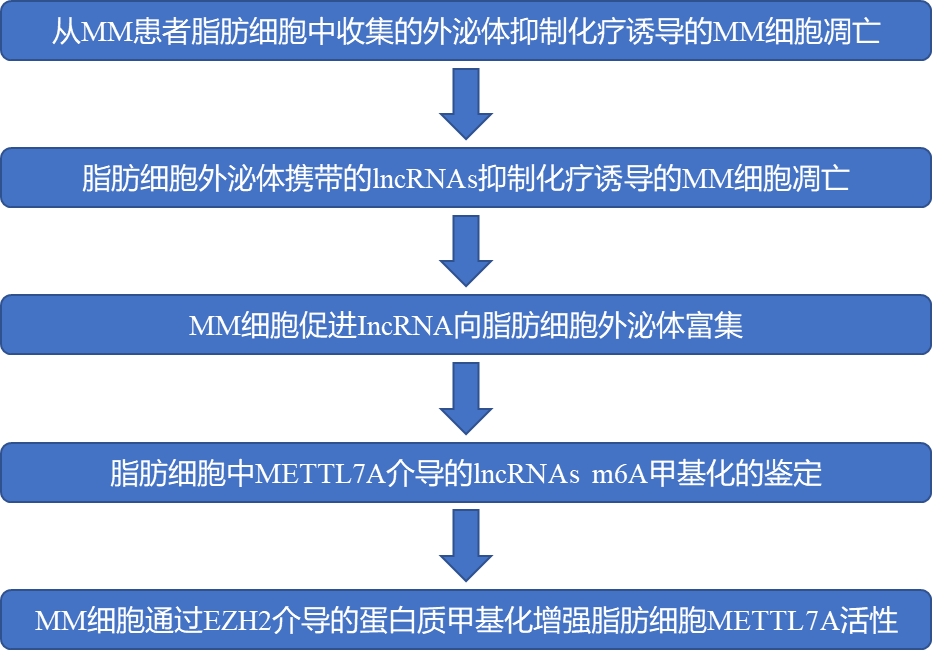
1、来自MM患者脂肪细胞的外泌体对化疗诱导的MM细胞凋亡具有保护作用
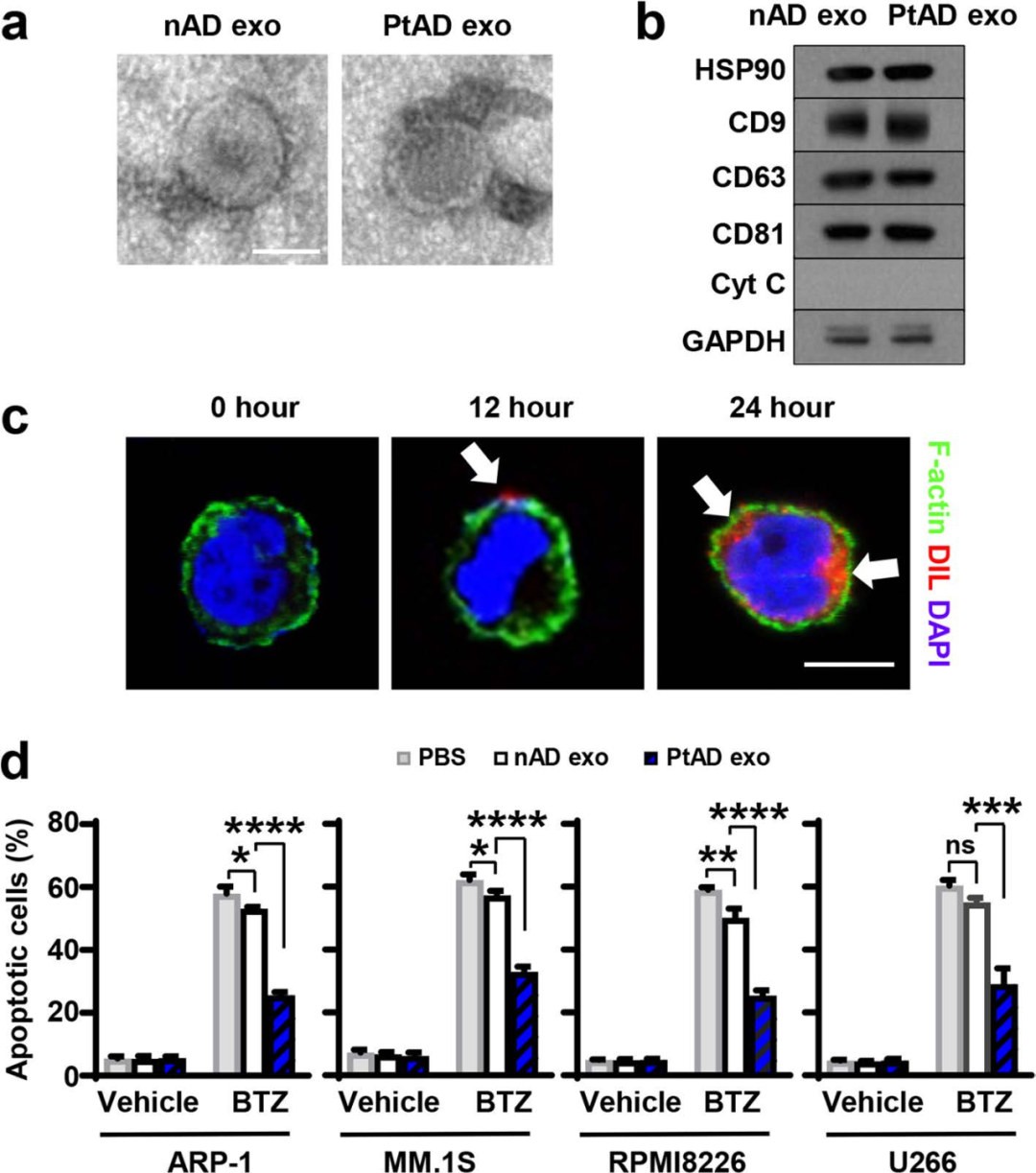
图1
该研究首先从正常骨髓(NADs)和多发性骨髓瘤(MM)患者骨髓(PtADs)中分离出脂肪细胞,利用透射电镜观察到从脂肪细胞培养液上清中收集到的外泌体呈杯状。随后将MM细胞与外泌体共培养,利用共聚焦显微镜发现被标记上Dil的外泌体存在于MM细胞的细胞膜上,并在胞浆内移动,表明脂肪细胞外泌体能够被MM细胞吸收。 该研究还发现NADs和PtADs的外泌体均能抑制化疗药物bortezomib(BTZ)诱导的MM细胞凋亡,其中PtADs外泌体的抑制作用更明显。说明脂肪细胞外泌体对MM耐药性具有潜在影响。
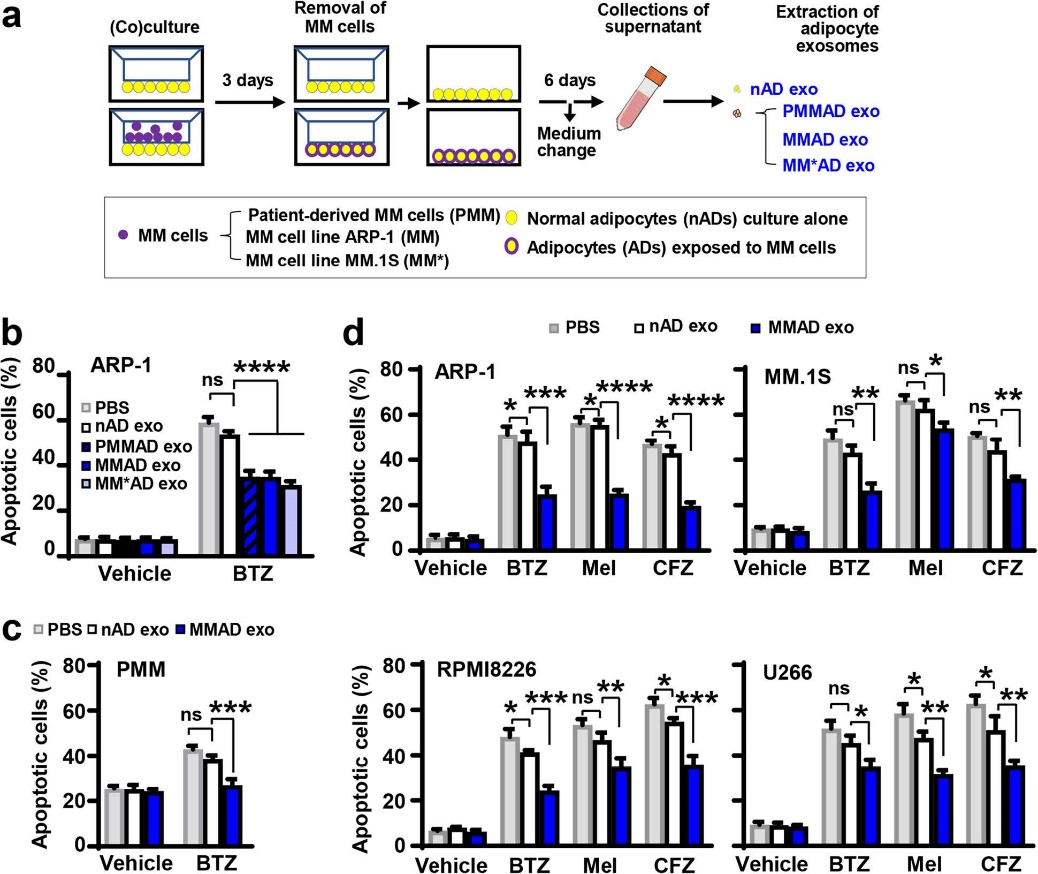
图2
将几种MM细胞系及对应化疗药物与MM相关脂肪细胞(MMADs)中的外泌体共培养,NADs外泌体作为对照。结果发现,与NADs相比,MMDAs外泌体显著降低了化疗药物的治疗效果。表明MM细胞可能增强脂肪细胞外泌体对MM细胞化疗耐药性的影响。
2、脂肪细胞外泌体携带的lncRNAs抑制MM细胞凋亡
图3
与NADs外泌体的lncRNAs相比,MMADs外泌体的lncRNAs(LOC606724和SNHG1)显著上调。利用MMRF CoMMpass RNA-seq数据库分析,发现LOC606724和SNHG1的表达与患者总生存期呈显著正相关。并且在MM细胞中过表达或敲除这两个lncRNAs可分别抑制或增强化疗药物的疗效。表明MMADs外泌体携带的lncRNAs对化疗诱导的MM细胞凋亡具有保护作用。
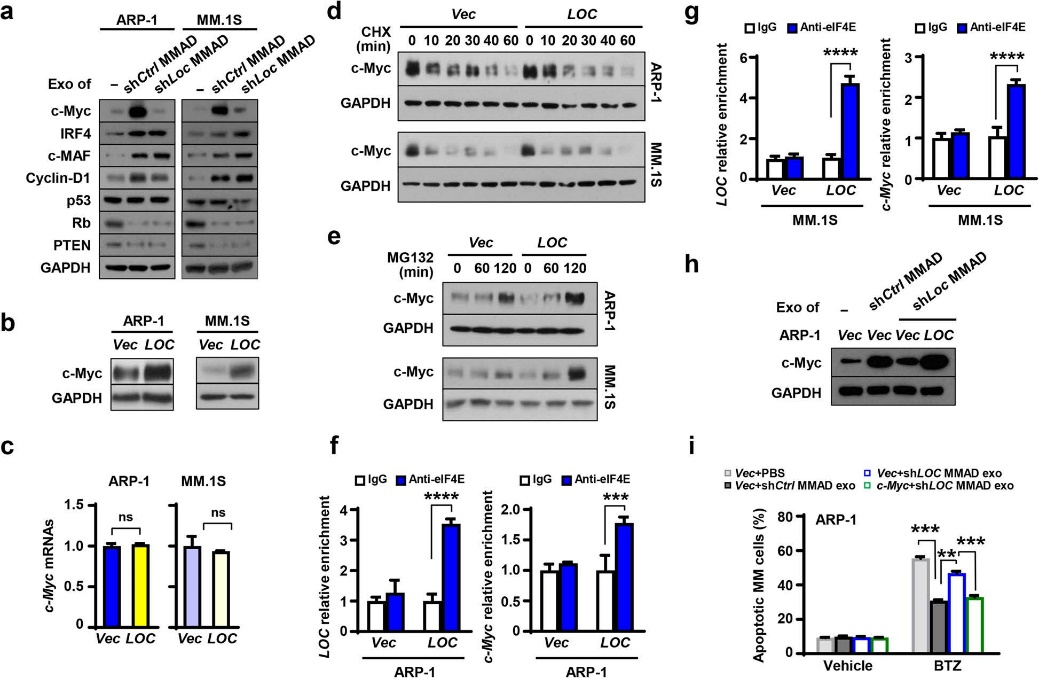
SNHG1已被证明参与调控肿瘤生长,作者后续对LOC606724如何调控MM细胞凋亡进行了研究。发现过表达或敲除脂肪细胞中的LOC606724可分别使MMADs中的癌蛋白c-Myc显著上调或下调,但不影响c-Myc mRNAs表达。表明LOC606724在转录后水平上调MM细胞中的c-Myc蛋白。
elF4E是蛋白翻译中的关键分子,通过RIP检测,发现c-Myc蛋白可与elF4E蛋白结合,并显著富集于过表达LOC606724的MM细胞,而过表达c-Myc可抑制化疗药物的疗效。表明LOC606724通过结合elF4E参与介导c-Myc蛋白合成。
3、MM细胞促进IncRNA向脂肪细胞外泌体富集
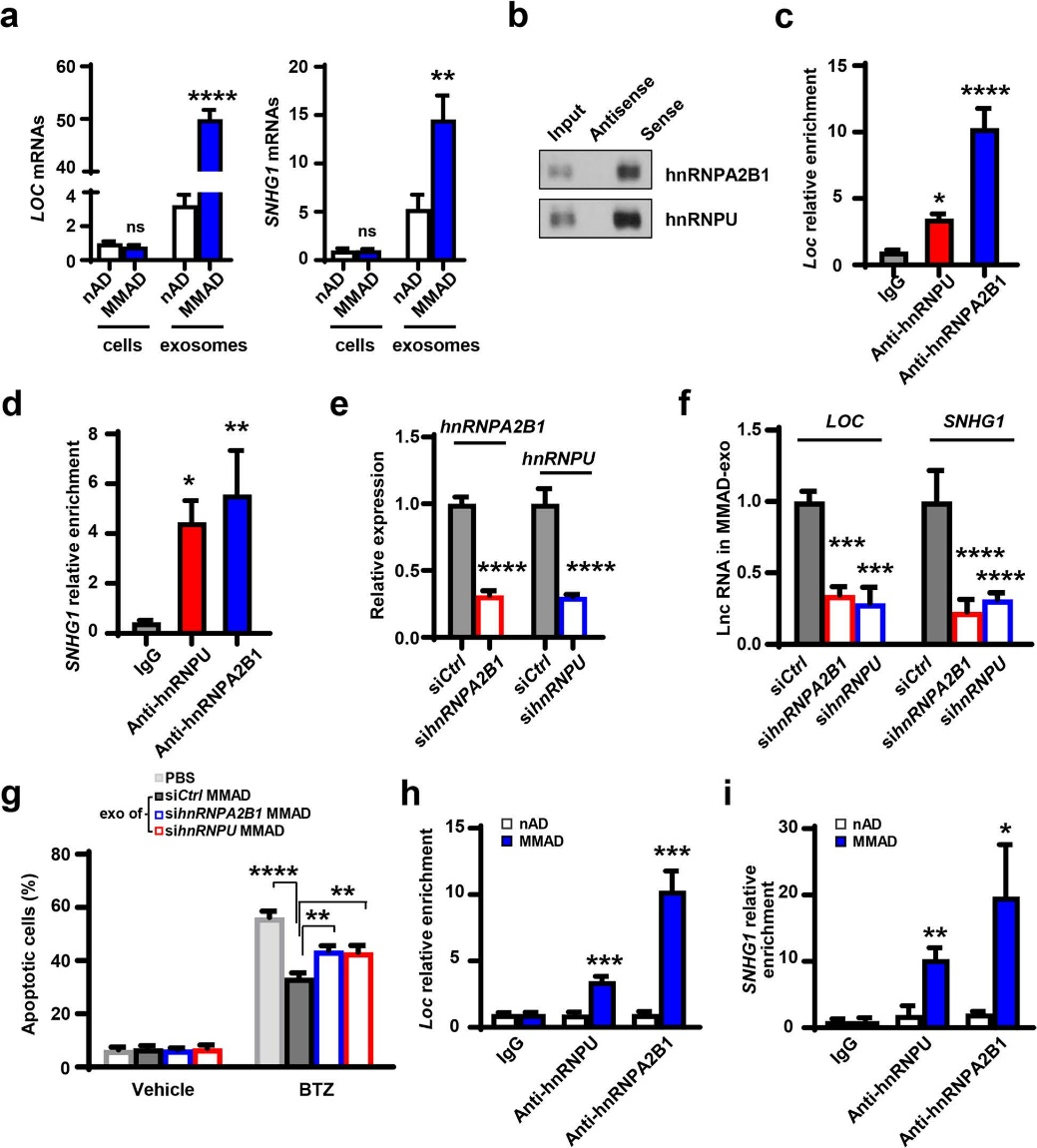
图5
通过分析NADs和MMADs在细胞或外泌体中lncRNAs的表达水平,发现外泌体中的lncRNAs显著上调,并且MMADs外泌体中的lncRNAs水平明显高于NADs。利用RNA pull-down实验检测到lncRNAs包装至外泌体中所需的RNA结合蛋白(hnRNPA2B1和hnRNPU)。利用这两个蛋白的抗体进行RIP实验,发现lncRNAs在MMADs中显著富集。利用siRNAs下调MMADs中的这两个蛋白后,可使MMADs外泌体中的lncRNAs下调,并诱导更多的MM细胞凋亡。这些结果表明,MM细胞可促进脂肪细胞中与RNA结合蛋白结合的lncRNAs被包装到外泌体中。
4、脂肪细胞中METTL7A介导的lncRNAs m6A甲基化的鉴定
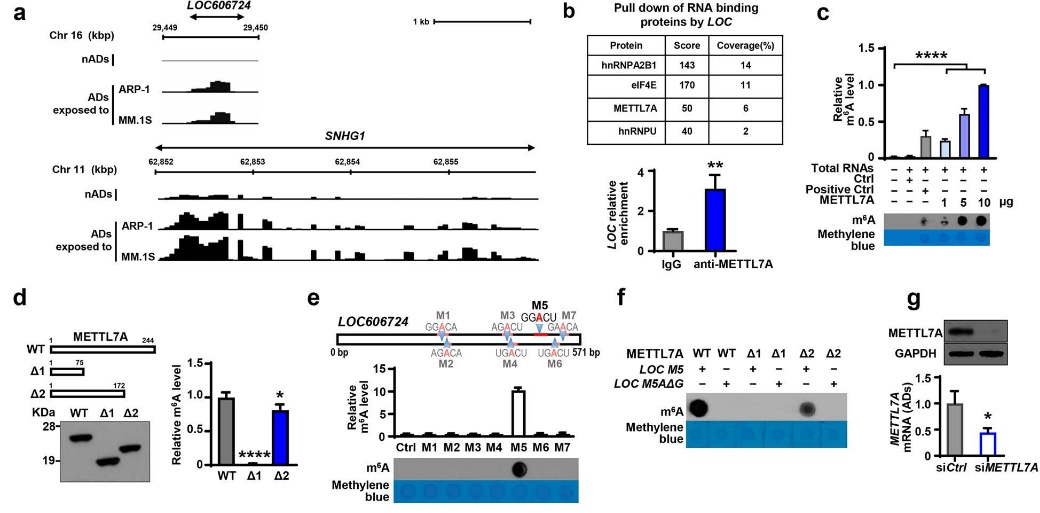
图6
使用MeRIP-seq对脂肪细胞进行研究,与NADs相比,MMADs中存在lncRNAs的甲基化。然后通过lncRNAs pull-down实验,发现MMADs裂解物中存在METTL7A。RIP实验进一步证实LOC606724富集于METTL7A。 随后作者通过构建和纯化His标记的重组METTL7A融合蛋白,进行了体外甲基转移酶活性分析,证实METTL7A具有m6A甲基转移酶活性,并且酶活性主要来自于METTL7A蛋白76-172 AA。然后作者利用SRAMP软件发现LOC606724上存在七个潜在的m6A motifs,并通过体外甲基化分析发现METTL7A蛋白可增加含有M5基序的RNA寡核苷酸的m6A水平。其中M5基序位于LOC606724的481nt处并含有AMP,当将这个AMP变为GMP后,m6A酶活性明显降低。这表明METTL7A蛋白的76-172AA与LOC606724的第481位AMP甲基化有关。
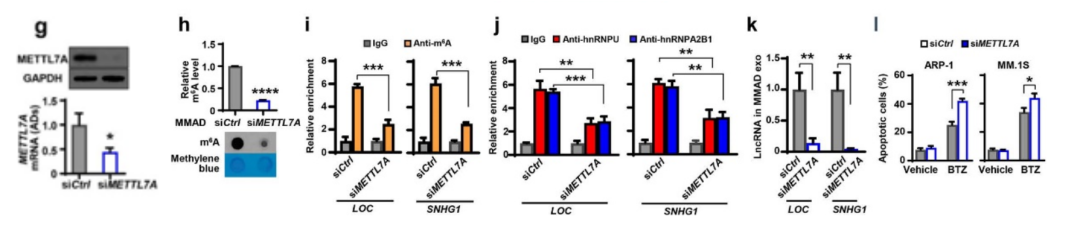
下一步,作者构建了MMADs的METTL7A沉默表达载体(siMETTL7A),通过m6A-RIP实验,发现MMADs中的m6A水平显著降低,lncRNAs对RNA结合蛋白的富集度下降,并导致外泌体lncRNAs显著下调。将MM细胞与siMETTL7A-MMADs的外泌体共培养后,MM细胞凋亡率明显提高。这些结果表明,具有甲基化转移酶活性的METTL7A有助于lncRNAs的m6A甲基化,甲基化的lncRNAs可以富集在脂肪细胞外泌体中。
5、MM细胞通过EZH2介导的蛋白质甲基化增强脂肪细胞的METTL7A活性
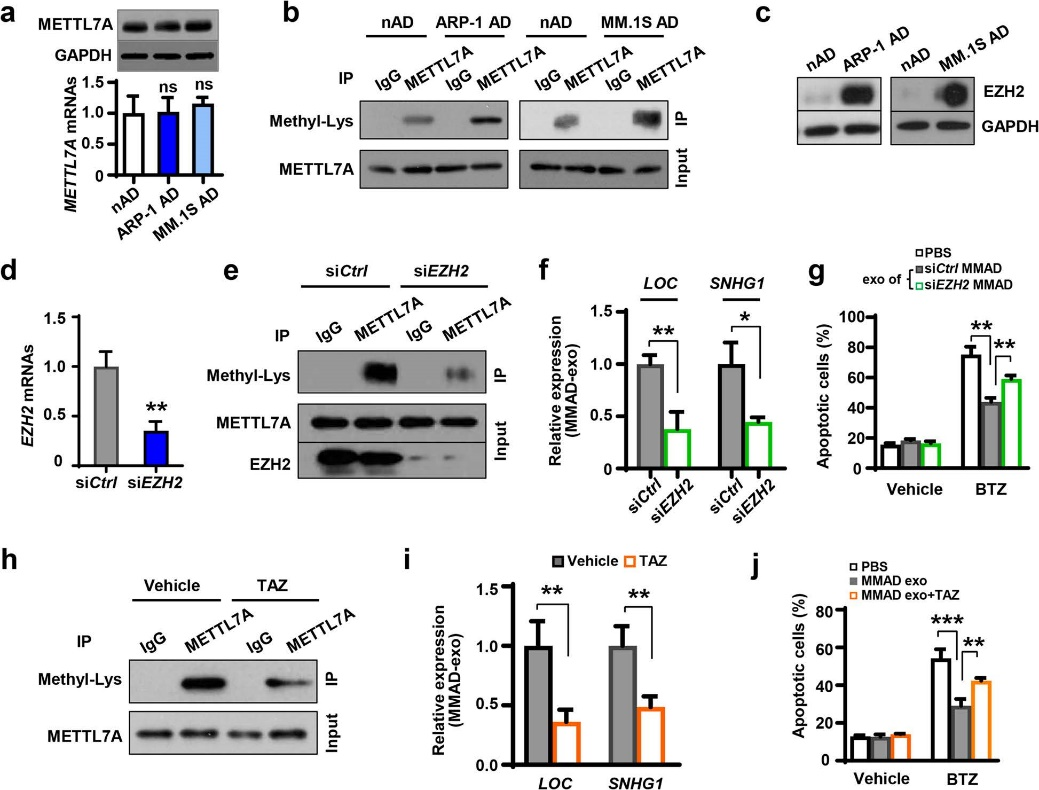
图7
通过使用抗METTL7A抗体拉下脂肪细胞裂解物,检测到MMADs免疫沉淀物中的METTL7A蛋白甲基化水平高于NADs的免疫沉淀物,表明MM细胞增强了METTL7A蛋白的甲基化。 EZH2是一种赖氨酸甲基转移酶,可以使组蛋白和非组蛋白甲基化。EZH2在MMADs中的表达水平高于NADs。作者构建的EZH2沉默载体(siEZH2)可使MMADs中的METTL7A蛋白甲基化水平以及lncRNAs表达水平降低,并使化疗药物治疗后的MM细胞凋亡率明显提升。表明EZH2能够增强脂肪细胞中METTL7A活性,从而促进lncRNAs甲基化,减少化疗后MM细胞的凋亡率,最终增强MM细胞的耐药性。
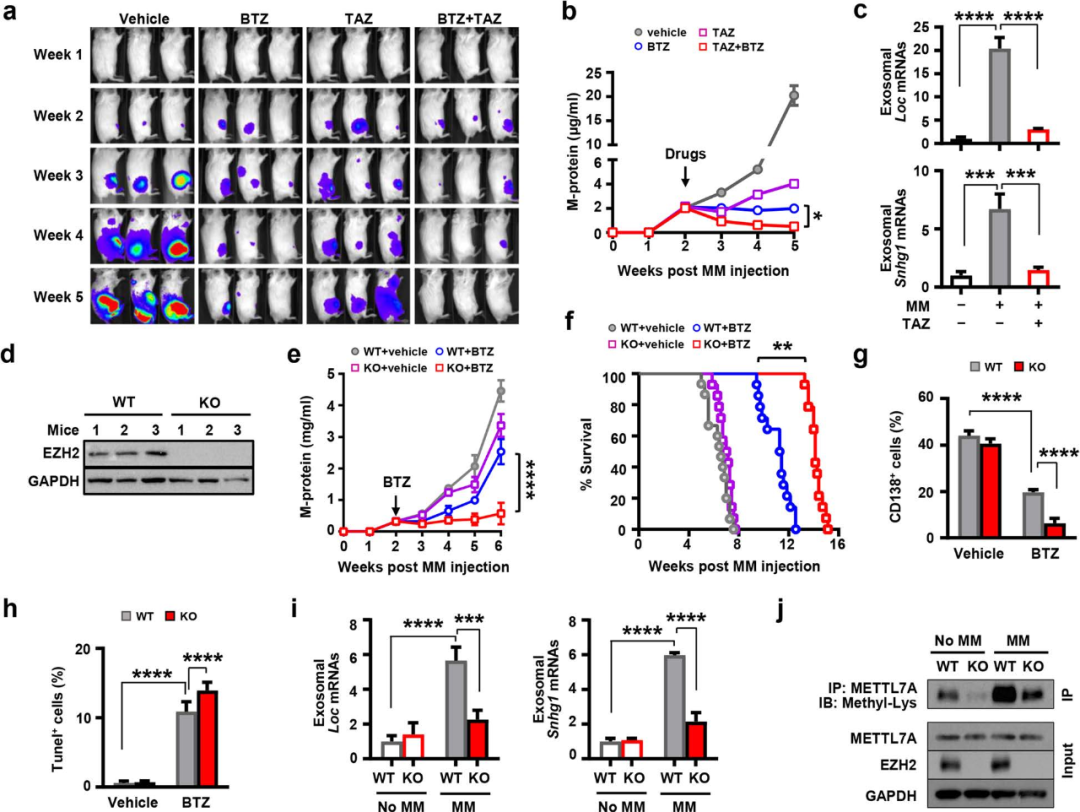
图8
接着作者构建了PDX模型,注射靶向药(bortezomib或tazemetostat)两周后,发现小鼠骨髓瘤明显缩小,并降低了脂肪细胞外泌体中lncRNAs的表达。构建EZH2敲除的MM小鼠模型后,发现靶向药治疗效果变得更好,并提高了小鼠生存率,而脂肪细胞中的METTL7A甲基化水平降低。表明脂肪细胞EZH2对MM细胞化疗具有潜在作用。
总之,该研究通过体外和体内实验,发现MM患者脂肪细胞中收集的外泌体及其中的lncRNAs (LOC606724和SNHG1)均可抑制化疗诱导的MM细胞凋亡,即增强了骨髓瘤细胞的耐药性。通过RIP、MERIP-seq和RNA-Protein pull-down实验发现lncRNAs可以与METTL7A蛋白互作,同时证实了METTL7A具有RNA甲基转移酶活性;最后研究表明MM细胞通过EZH2介导的METTL7A蛋白甲基化增强了METTL7A活性,从而促进lncRNAs包装到脂肪细胞外泌体中。该研究指出了一种通过阻断外泌体介导的肿瘤恶性循环来提高癌症治疗效果的潜在策略。
