
— 摘要 —
细胞凋亡与坏死是两种完全不同的细胞凋亡形式,根据死亡细胞在形态学、生物化学和分子生物学上的差别,可以将二者区别开来。
细胞凋亡的检测方法有很多,下面介绍几种常用的测定方法。
一、细胞凋亡的形态学检测
根据凋亡细胞固有的形态特征,人们已经设计了许多不同的细胞凋亡形态学检测方法。
1. 光学显微镜和倒置显微镜
(1) 未染色细胞:
凋亡细胞的体积变小、变形,细胞膜完整但出现发泡现象,细胞凋亡晚期可见凋亡小体。贴壁细胞出现皱缩、变圆、脱落。
(2) 染色细胞:
常用姬姆萨染色、瑞氏染色等。凋亡细胞的染色质浓缩、边缘化,核膜裂解、染色质分割成块状和凋亡小体等典型的凋亡形态。
2. 荧光显微镜和共聚焦激光扫描显微镜
一般以细胞核染色质的形态学改变为指标来评判细胞凋亡的进展情况。
常用的DNA特异性染料有:HO 33342 (Hoechst 33342),HO 33258 (Hoechst 33258), DAPI。三种染料与 DNA的结合是非嵌入式的,主要结合在DNA的A-T碱基区。紫外光激发时发射明亮的蓝色荧光。
Hoechst是与DNA特异结合的活性染料,储存液用蒸馏水配成1mg/ml的浓度,使用时用PBS稀释成终浓度为2~5mg/ml。DAPI为半通透性,用于常规固定细胞的染色。储存液用蒸馏水配成1mg/ml的浓度,使用终浓度一般为0.5 ~1mg/ml。
结果评判:细胞凋亡过程中细胞核染色质的形态学改变分为三期:Ⅰ期的细胞核呈波纹状(rippled)或呈折缝样(creased),部分染色质出现浓缩状态;Ⅱa期细胞核的染色质高度凝聚、边缘化;Ⅱb期的细胞核裂解为碎块,产生凋亡小体(图1)。

3 .透射电子显微镜观察
结果评判:凋亡细胞体积变小,细胞质浓缩。凋亡Ⅰ期(pro-apoptosis nuclei)的细胞核内染色质高度盘绕,出现许多称为气穴现象(cavitations)的空泡结构(图2);Ⅱa期细胞核的染色质高度凝聚、边缘化;细胞凋亡的晚期,细胞核裂解为碎块,产生凋亡小体。

二、磷脂酰丝氨酸外翻分析(Annexin V法)
磷脂酰丝氨酸(Phosphatidylserine, PS)正常位于细胞膜的内侧,但在细胞凋亡的早期,PS可从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中(图3)。Annexin-V是一种分子量为35~36KD的Ca2+依赖性磷脂结合蛋白,能与PS高亲和力特异性结合。将Annexin-V进行荧光素(FITC、PE)或biotin标记,以标记了的Annexin-V作为荧光探针,利用流式细胞仪或荧光显微镜可检测细胞凋亡的发生。
碘化丙啶(propidine iodide, PI)是一种核酸染料,它不能透过完整的细胞膜,但在凋亡中晚期的细胞和死细胞,PI能够透过细胞膜而使细胞核红染。因此将Annexin-V与PI匹配使用,就可以将凋亡早晚期的细胞以及死细胞区分开来。

方法:
1. 悬浮细胞的染色:将正常培养和诱导凋亡的悬浮细胞(0.5~1×106)用PBS洗2次,加入100 ul Binding Buffer和FITC标记的Annexin-V(20ug/ml)10 ul,室温避光30 min,再加入PI(50 ug/ml)5 ul,避光反应5 min后,加入400 ul Binding Buffer,立即用FACScan进行流式细胞术定量检测(一般不超过1 h), 同时以不加AnnexinV-FITC及PI的一管作为阴性对照。
2. 贴壁培养的细胞染色:先用0.25%的胰酶消化,洗涤、染色和分析同悬浮细胞。
3. 爬片细胞染色:同上,最后用荧光显微镜和共聚焦激光扫描显微镜进行观察。结果 [图4、图5]


注意事项:
1. 整个操作动作要尽量轻柔,勿用力吹打细胞。
2. 操作时注意避光,反应完毕后尽快在一小时内检测。
三、线粒体膜势能的检测
线粒体在细胞凋亡的过程中起着枢纽作用,多种细胞凋亡刺激因子均可诱导不同的细胞发生凋亡,而线粒体跨膜电位DYmt的下降,被认为是细胞凋亡级联反应过程中最早发生的事件,它发生在细胞核凋亡特征(染色质浓缩、DNA断裂)出现之前,一旦线粒体DYmt崩溃,则细胞凋亡不可逆转。
线粒体跨膜电位的存在,使一些亲脂性阳离子荧光染料如Rhodamine 123、3,3-Dihexyloxacarbocyanine iodide[DiOC6(3)]、Tetrechloro-tetraethylbenzimidazol carbocyanine iodide[JC-1]、Tetramethyl rhodamine methyl ester(TMRM)等可结合到线粒体基质,其荧光的增强或减弱说明线粒体内膜电负性的增高或降低。
方法:将正常培养的细胞和诱导凋亡的细胞加入使用终浓度为Rhodamine 123(1mM)或终浓度为DiOC6(25nM),JC-1(1mM),TMRM(100nM),37°C平衡30min,流式细胞计检测细胞的荧光强度。
注意事项:
1. 始终保持平衡染液中pH值的一致性,因为pH值的变化将影响膜电位。
2. 与染料达到平衡的细胞悬液中如果含有蛋白,他们将与部分染料结合,降低染料的浓度,引起假去极化。
四、DN**断化检测
细胞凋亡时主要的生化特征是其染色质发生浓缩, 染色质DNA在核小体单位之间的连接处断裂, 形成50~300 kbp长的DNA大片段, 或180~200 bp整数倍的寡核苷酸片段, 在凝胶电泳上表现为梯形电泳图谱(DNA ladder)。细胞经处理后,采用常规方法分离提纯DNA,进行琼脂糖凝胶和溴化乙啶染色,在凋亡细胞群中可观察到典型的DNA ladder。如果细胞量很少,还可在分离提纯DNA后,用32P-ATP和脱氧核糖核苷酸末端转移酶(TdT)使DNA标记,然后进行电泳和放射自显影,观察凋亡细胞中DNA ladder的形成。
1. 大分子染色体DN**段的测定
细胞凋亡的早期,染色体断裂成为50~300 kbp长的DNA大片段。所有超过一定分子量大小的双链DNA分子在琼脂糖凝胶中的迁移速度相同。线性DNA的双螺旋半径超过凝胶半径时,即达到分辨力的极限。此时凝胶不再按分子量的大小来筛分DNA,DNA像通过弯管一样,以其一端指向电场一极而通过凝胶,这种迁移模式称之为"爬行"。因此,细胞凋亡早期产生的50~300 kbp长的DNA大片段不能用普通的琼脂糖凝胶电泳来分离。通常采用脉冲电泳技术可圆满地解决这一问题。这个方法是在凝胶上外加正交的交变脉冲电场。每当电场方向改变后,大的DNA分子便滞流在爬行管中,直至新的电场轴向重新定向后,才能继续向前移动。DNA分子量越大,这种重排所需要的时间就越长。当DNA分子变换方向的时间小于电脉冲周期时,DNA就可以按其分子量大小分开。
参考文献:Brown,D.G., Sun, X.M., and Cohen, G.M.(1993) Dexamethasone-induced apoptosis involves cleavage of DNA to large fragments prior to internucleosomal fragmentation. J. Biol.Chem. 268, 3037-3039
2. DNA Ladder 测定
方法:收获细胞(1′107)沉淀细胞裂解液13000rpm′5 min, 收集上清1%SDS和RnaseA(5mg/ml)56 °C,2 h蛋白酶K(2.5 mg/ml)37 °C,2h1/10体积3M醋酸钠和2.5倍体积的冷无水乙醇沉淀DNA,4 °C过夜14000 rpm′15 min最后将沉淀溶解在TE buffer中,加DNA Loading Buffer1.2%琼脂糖凝胶电泳,EB染色并照相。
结果:
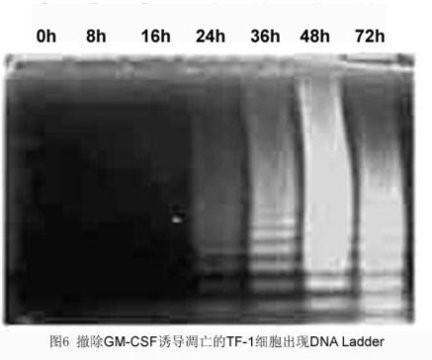
参考文献:Herrmannm M, Lorenz HM, Voll R et al. A Rapid and simple method for the isolation of apoptotic DNA fragments. Nucleic Acid Res. 1994; 22:5506-5507
3. 凋亡细胞DNA含量的流式细胞计分析
方法:收集细胞70%冷乙醇(in PBS)4°C固定过夜PBS洗涤,1000 rpm′10 minRNase A(0.5 mg/ml)37 °C消化30 minPI(50 mg/ml)染色,室温避光15 minFACScan分析DNA亚二倍体的形成及细胞周期的变化。
结果:

4. ApoAlertTM LM-PCR Ladder Assay (CLONTECH)
优点:敏感度高,适合于检测少量样本,小部分凋亡细胞。如临床活组织检测。
五 、TUNEL法
细胞凋亡中, 染色体DNA双链断裂或单链断裂而产生大量的粘性3'-OH末端,可在脱氧核糖核苷酸末端转移酶(TdT)的作用下,将脱氧核糖核苷酸和荧光素、过氧化物酶、碱性磷酸酶或生物素形成的衍生物标记到DNA的3'-末端,从而可进行凋亡细胞的检测,这类方法称为脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(terminal -deoxynucleotidyl transferase mediated nick end labeling, TUNEL)。由于正常的或正在增殖的细胞几乎没有DNA的断裂,因而没有3'-OH形成,很少能够被染色。TUNEL实际上是分子生物学与形态学相结合的研究方法,对完整的单个凋亡细胞核或凋亡小体进行原位染色,能准确地反应细胞凋亡典型的生物化学和形态特征,可用于石蜡包埋组织切片、冰冻组织切片、培养的细胞和从组织中分离的细胞的细胞形态测定,并可检测出极少量的凋亡细胞,因而在细胞凋亡的研究中被广泛采用。
六、Caspase-3活性的检测
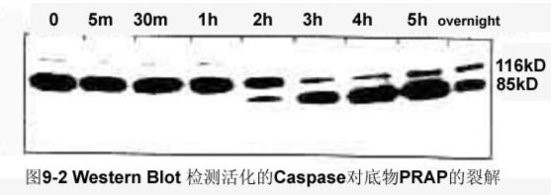
Caspase家族在介导细胞凋亡的过程中起着非常重要的作用,其中caspase-3为关键的执行分子,它在凋亡信号传导的许多途径中发挥功能。Caspase-3正常以酶原(32KD)的形式存在于胞浆中,在凋亡的早期阶段,它被激活,活化的Caspase-3由两个大亚基(17KD)和两个小亚基(12KD)组成,裂解相应的胞浆胞核底物,最终导致细胞凋亡。但在细胞凋亡的晚期和死亡细胞,caspase-3的活性明显下降。
1. Western blot 分析Procaspase-3的活化,以及活化的Caspase-3及对底物多聚(ADP-核糖)聚合酶[poly(ADP-ribose)polymerase,PARP]等的裂解。
方法:
收集细胞→PBS洗涤→抽提细胞裂解液→蛋白定量→SDS-PAGE电泳→**纤维素膜或PVDF膜转移→5%脱脂奶粉封闭,室温1.5~2 h或4 °C过夜→Caspase-3多抗或单抗室温反应1~2 h或4 °C过夜→TBS-T(含0.05% Tween 20的TBS)洗3次,5~10 min/次→HRP-标记的羊抗鼠IgG或AP标记的羊抗鼠IgG室温反应1~2h→ TBS-T洗3次, 5~10 min/次→ECL显影或NBT/BCIP显色。
结果:

2. 荧光分光光度计分析
原理:活化的Caspase-3能够特异切割D1E2V3D4-X底物,水解D4-X肽键。根据这一特点,设计出荧光物质偶联的短肽Ac-DEVD-AMC。在共价偶联时,AMC不能被激发荧光,短肽被水解后释放出AMC,自由的AMC才能被激发发射荧光。根据释放的AMC荧光强度的大小,可以测定caspase-3的活性,从而反映Caspase-3被活化的程度。
方法:收获细胞正常或凋亡细胞PBS洗涤制备细胞裂解液,加Ac-DEVD-AMC(caspase-3四肽荧光底物)37 °C反应1 h荧光分光光度计(Polarstar)分析荧光强度(激发光波长380 nm,发射光波长为430-460 nm)。
结果:

3. 流式细胞术分析
方法:收获细胞正常或凋亡细胞PBS洗涤加Ac-DEVD-AMC37 °C反应1hUV流式细胞计分析caspase-3阳性细胞数和平均荧光强度。
结果:

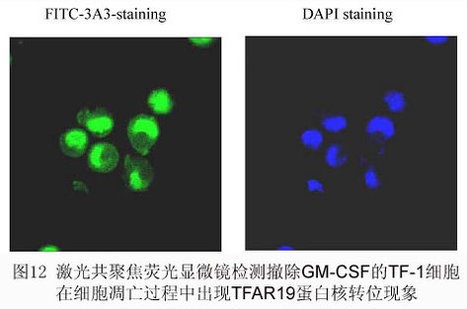
七、凋亡相关蛋白TFAR19蛋白的表达和细胞定位分析
TFAR19(PDCD5)是由本研究室在国际上首先报导的一个拥有自己知识产权的人类新基因,前期的功能研究表明,它是促进细胞凋亡的增强剂。利用荧光素(FITC)标记的TFAR19单克隆抗体为探针,对细胞凋亡过程中TFAR19蛋白的表达水平及定位研究发现,凋亡早期TFAR19表达水平增高并出现快速核转位现象,伴随着细胞核形态学的变化,持续较长时间,在凋亡小体中仍然可见。同时我们发现,凋亡早期TFAR19蛋白的核转位早于磷脂酰丝氨酸(PS)外翻和细胞核DNA的片段化,提示TFAR19蛋白的核转位是细胞凋亡更早期发生的事件之一。进一步的研究证明,凋亡早期TFAR19的核转位具有普遍意义,不同细胞凋亡早期均出现TFAR19高表达和核转位。这为研究细胞凋亡早期所发生的事件,提供了一种新的技术和指标。
(一)TFAR19蛋白的细胞定位分析
材料试剂:
FITC标记的单克隆抗体,pH7.4 、0.15Mol/L PBS,3%的多聚甲醛,PBS-T(pH7.4 、0.15Mol/L PBS 含0.2% Tween 20),胎牛血清,荧光细胞洗液:pH7.4 、0.15Mol/L PBS含2%胎牛血清及0.1%NaN3 。FACS管,Tip头,移液器。
仪器:低温水平离心机, 37 °C水浴箱,荧光显微镜,共聚焦激光扫描显微镜,流式细胞计
方法:
1. 悬浮细胞的染色:
(1)收获正常和诱导凋亡的细胞(0.5~1′106),PBS洗2次,1000 rpm′10 min。
(2)3%多聚甲醛冰浴10 min,PBS洗2次,1000 rpm′10 min。
(3)加入PBS-T溶液,37 °C孵育15 min,PBS洗2次,1000 rpm′10 min。
(4)加入200 ml胎牛血清,室温反应30 min。
(5)加入5 ml FITC标记的TFAR19单抗(终浓度为1:40),4 °C反应30 min
(6)荧光细胞洗液洗2次,1000 rpm′10 min。
结果观察:将细胞沉淀滴片,荧光显微镜及共聚焦激光显微镜下观察TFAR19在细胞中的定位。同时用流式细胞计定量检测TFAR19蛋白的平均荧光强度。
2. 贴壁细胞的原位染色
(1) 贴壁生长的对数期细胞铺在24孔或6孔板中(内有洁净盖玻片),让其爬片生长,待长到50%~80%满时,凋亡诱导剂处理细胞。
(2) 将不同时间点处理的细胞进行免疫荧光染色,染色步骤同上。
(3) 将染色的爬片细胞放于一张滴有少量甘油(5ml)的载玻片上,荧光显微镜或共聚焦激光扫描显微镜观察TFAR19在细胞中的定位。
结果观察:

1. 临床病理切片的染色、检测。
2. 原代细胞的培养、检测。
3. 分析TFAR19蛋白在人体内各组织器官的分布及定位
(二)TFAR19蛋白的表达与临床疾病
ELISA法检测正常人和疾病状态下,以及疾病的不同时期,血清中TFAR19蛋白水平及其TFAR19自身抗体水平。
材料和试剂:
1. 包被Buffer: pH9.6, 0.05 Mol/L碳酸盐Buffer
2. 洗涤液: pH7.4, 0.15 Mol/L PBS 含0.05% Tween 20
3. 封闭液: 3%BSA(用洗涤液配制)
4. 酶标抗体的稀释:用封闭液稀释
5. OPD底物Buffer:Na2HPO4.12H2O 1.84 g 柠檬酸 0.51 g DDW 100 ml
6. 显色液(现配现用):底物Buffer 10 ml OPD 2 mg 30% H2O2 2 ml
7. 终止液 2 Mol/L H2SO4
8. 重组人TFAR19, HRP标记的羊抗人IgG9. ELISA板, Tip, 移液器,ELISA Reader(OD490 nm),洗板机
操作步骤:
1. 用包被Buffer稀释的重组人TFAR19(1 mg/ml)包被ELISA板, 100 ml/well, 37 °C孵育2h或4 °C过夜(一般24 h以上)。
2. 洗涤Buffer洗板三次,加入封闭液,200 ml/well , 37 °C孵育2h或4 °C过夜。
3. 洗涤Buffer洗板三次,加入不同稀释度的病人血清(3个重复孔)100 ml/well ,37 °C孵育1 h。设包被Buffer、洗涤Buffer 、封闭液为阴性对照。
4. 洗涤Buffer洗板三次,加入1:2500稀释的HRP标记的抗人IgG, 100 ml/well,37 °C孵育1 h。
5. 洗涤Buffer洗板三次,加入显色液,100 ml/well,避光反应10~15 min。
6. 加入H2SO4终止反应,50 ml/well。
7. ELISA Reader 读取OD490光密度值,分析和比较病人血清和正常血 清中TFAR19自身抗体的表达水平。
8. Western blot 分析原发性肿瘤细胞和正常细胞的TFAR19蛋白的表达水平。
细胞坏死的鉴定
细胞坏死是因病理而产生的被动死亡,如物理性或化学性的损害因子及缺氧与营养不良等均导致细胞坏死。坏死细胞的膜通透性增高,致使细胞肿胀,细胞器变形或肿大,早期核无明显形态学变化,最后细胞破裂。另外坏死的细胞裂解要释放出内含物,并常引起炎症反应;在愈合过程中常伴随组织器官的纤维化,形成瘢痕。
