阿尔茨海默病(AD)是一种广泛的神经退行性脑疾病,它影响着全球约4400万人。虽然目前对AD的特征有了一定的了解,但多种分子和细胞变化机制仍不清楚。
最近,在细胞间发挥通信作用的细胞外囊泡(EV)正成为一种新的疾病治疗热点。已有研究表明,从脑组织和生物液体中分离出来的EV在AD中发生了改变,因此,从患者的生物体液或活检样本中捕获细胞类型特异性EV,并对其进行分析,成为研究AD的一种新方法。
2022年,来自哈佛医学院的研究团队在Journal of Extracellular Vesicles(IF 21.224)发表了一篇题为“Human neural cell type-specific extracellular vesicle proteome defines disease-related molecules associated with activated astrocytes in Alzheimer's disease brain”的研究论文。文章利用labelfree蛋白组学和TMT蛋白组学研究了不同细胞类型中的EV的蛋白质组谱并鉴定出新的细胞类型特异性EV蛋白标记物,同时证明了细胞类型特异性EV在AD进展中发挥的重要作用,并可作为AD的潜在生物标志物。
研究材料
人类诱导多能干细胞(hiPSC)分化的神经细胞,健康对照、轻度认知障碍患者和阿尔兹海默症患者的脑组织 技术路线 步骤1:人类诱导多能干细胞(hiPSC)分化为四种类型的神经细胞; 步骤2:分化的四种神经细胞中提取胞外囊泡(EV); 步骤3:四种神经细胞EV蛋白质组的比较分析; 步骤4:细胞类型特异性EV中标志蛋白的确定; 步骤5:人类脑组织中分离的EV的蛋白质组学分析; 步骤6:细胞类型特异性EV蛋白共表达网络的构建; 步骤7:M7模块与激活的星形胶质细胞来源的EV和AD病理的相关性分析。 研究结果 1. 人类诱导多能干细胞的分化及分化有效性确认 作者首先用人类诱导多能干细胞(hiPSC)分化成四种神经细胞类型:星形胶质细胞、小胶质细胞、神经元和少突胶质细胞(图1a),并通过RT-PCR和功能实验进行分化有效性的验证(图1b-1f)。其次,采用非标记定量蛋白组学(label free)的方法对四种类型的细胞进行蛋白质谱分析,共鉴定到3206个蛋白(图1g),组学结果发现四种分化神经细胞分别对应的细胞类型特异性蛋白标志物的表达量均比较高,这进一步证明了hiPSC细胞分化的有效性(图1h)。
图1 hiPSC分化及分化有效性确认
2. hiPSC分化的神经细胞中分离胞外囊泡并进行表征 作者从hiPSC分化的的四种类型的神经细胞中分离胞外囊泡(EV),使用NTA和TEM方法进行表征分析证明EV的纯度(图2a-2c)。针对胞外囊泡的非标记定量蛋白组学(label free)实验,发现非EV的蛋白未在EV中检测到,进一步证明了分离的EV的高纯度(图2d-2e)。同时根据质谱结果,作者筛选到了16个在四种分化神经细胞中均同时表达的蛋白,即烯醇酶1(ENO1)、热休克蛋白(HSPA8)、Ras相关蛋白(RAB7A)、整联蛋白ITGB1、膜联蛋白(含ANXA1、2、5、6)、基础免疫球蛋白(BSG)、一类过氧化物酶(含PRDX1、2)、前列腺素F2受体负调节因子(PTGFRN)、皮离蛋白(DCD)、CD59和ACTB、GAPDH(图2g)。
图2 hiPSC分化的神经细胞中分离胞外囊泡
3. 神经细胞类型特异性EV蛋白质组的比较 为了确定四种神经细胞分离的胞外囊泡蛋白组成的差异,作者比较了囊泡蛋白的丰度,PCA和相关系数结果显示不同EV蛋白组成具有细胞类型特异性(图3a-3b)。根据聚类分析结果筛选到了不同细胞类型特异性的差异表达EV蛋白(图3c),他们参与了不同的生物过程(GO_BP)和KEGG通路(图3d),如星形胶质细胞特异的EV蛋白主要富集在与细胞外基质相关的生物学过程(包括细胞粘附、细胞外基质(ECM)受体相互作用和整合素介导的信号转导)以及生物代谢相关通路(包括糖酵解、丙酮酸代谢过程、胆固醇稳态、氨基酸的生物发生和碳代谢)。
图3 hiPSC分化的细胞类型特异性EV蛋白组的比较分析
4. hiPSC分化的细胞类型特异性EV中标志蛋白的确定 由于EV蛋白在不同的hiPSC分化神经细胞中具有细胞类型特异性,故作者进一步筛选特定的特异性蛋白作为脑源EV的细胞类型特异性生物标记物。通过初步筛选(图4a-b)和验证实验(图4c-4d),最终确定将NCAM1, ATP1A3作为神经元EV的标志物, LRP1, ITGA6, EAAT1作为星形胶质细胞EV的标志物, LCP1作为小胶质细胞EV的标志物, LAMP2, FTH1和 MOG 作为少突胶质细胞EV标志物。
图4 细胞类型特异性EV中标志蛋白的鉴定
5. 人类脑组织中分离的胞外囊泡的蛋白质组学分析 为了加强蛋白组学的研究发现以及探索其潜在的临床应用,作者对30个人(包括11名健康对照(HC)、8名轻度认知障碍患者(MCI)和11名AD患者)的脑组织EV进行了TMT标记定量蛋白组学分析(图5a),共鉴定到4286个脑源性EV蛋白(其中2645个为共有蛋白),差异比较分析筛选到242个显著改变的蛋白(图5c)。此外,作者筛选到了多个疾病特异性差异表达蛋白,为区分从HC、MCI和AD大脑中分离出来的EV提供了可能(图5e)。
图5 30例人脑组织中分离出的EV的蛋白组学分析
6. 细胞类型特异性的EV蛋白共表达网络的构建 已知WGCNA(加权基因共表达网络分析)可用于确定神经退行性疾病相关的关键分子途径和潜在治疗靶点,作者利用2645个共有蛋白构建了一个AD EV的WGCNA共表达网络(图6a)并将其与AD的三个神经病理特征(临床痴呆、斑块负荷、神经纤维缠结负荷)进行关联分析,结果表明M7模块(与质膜的固有成分相关)与AD病理特征成正相关 (图6b)。 进一步对细胞类型标志物在每个共表达模块中的富集情况进行分析,发现在M7模块显著富集星形胶质细胞EV标记物,且与AD性状显著正相关,意味着星形细胞来源的EV蛋白标志物或许可作为AD的生物标志物(图6c)。此外,作者还根据疾病状态测量模块特征蛋白值预测可能影响MCI到AD变化的EV蛋白(图6d)。
图6 脑源EV蛋白共表达网络的构建
7. M7/星形胶质细胞模块在激活的星形细胞来源的EV标记物中富集,并与AD病理相关 上述结果可以看出M7模块表现出与AD特征(图6b)和星形胶质细胞来源的EV的关联性最强(图6c),作者进一步验证了M7模块是否与激活的星形胶质细胞来源的EV相关。结果显示M7模块在有活性的星形胶质细胞来源的EV中显著富集(此部分定义为M7/星形胶质细胞模块)(图7a),且与前10个中心蛋白(与AD症状相关)发生密切的相互作用(图7b)。此外,为了进一步验证来自M7星形细胞模块的EV蛋白是否与AD病理相关,作者利用IP实验在5名HC和5名AD患者中验证了活性星形胶质细胞来源的EV标志物与M7模块中的中心蛋白(ITGB1)的相互作用(图7e-7g)。上述结果表明在AD发病机制中,M7星形胶质细胞模块中的EV蛋白共表达网络发挥主导作用,鉴定出的M7 EV蛋白(如ITGB1),特别是在星形细胞特异性EV中,可作为潜在的AD生物标志物。 小编小结 在本研究中,作者使用labelfree非标记定量蛋白组学方法分析了hiPSC来源的四种不同神经细胞类型(neuron、iAstrocytes、iMGL和iOligos)中分离出的胞外囊泡(EV)的蛋白质谱。利用这些独特的蛋白质组数据集,共鉴定出16种通用蛋白作为新的脑泛EV标志物候选蛋白。对神经细胞类型特异性EV蛋白进行表征,这些蛋白可作为脑细胞类型特异性EV分离的潜在标记物。此外作者使用TMT标记定量蛋白组学对AD、MCI和HC脑源性EVs进行分析,并结合WGCNA的方法利用细胞类型特异性EV蛋白生成了AD脑源性EV蛋白共表达网络。 中科优品推荐 细胞外囊泡(extracellular vesicle,EV)是由细胞释放的各种具有膜结构的囊泡统称。外泌体属于其中的一种,也是目前研究较为成熟的。现外泌体已经成为国自然等的研究热点。 【中科新生命】提供外泌体“提取-表征-组学分析-数据挖掘”全流程服务,免去多方沟通烦恼。全程高质量保证,为您的课题研究保驾护航。欢迎感兴趣的老师前来咨询。
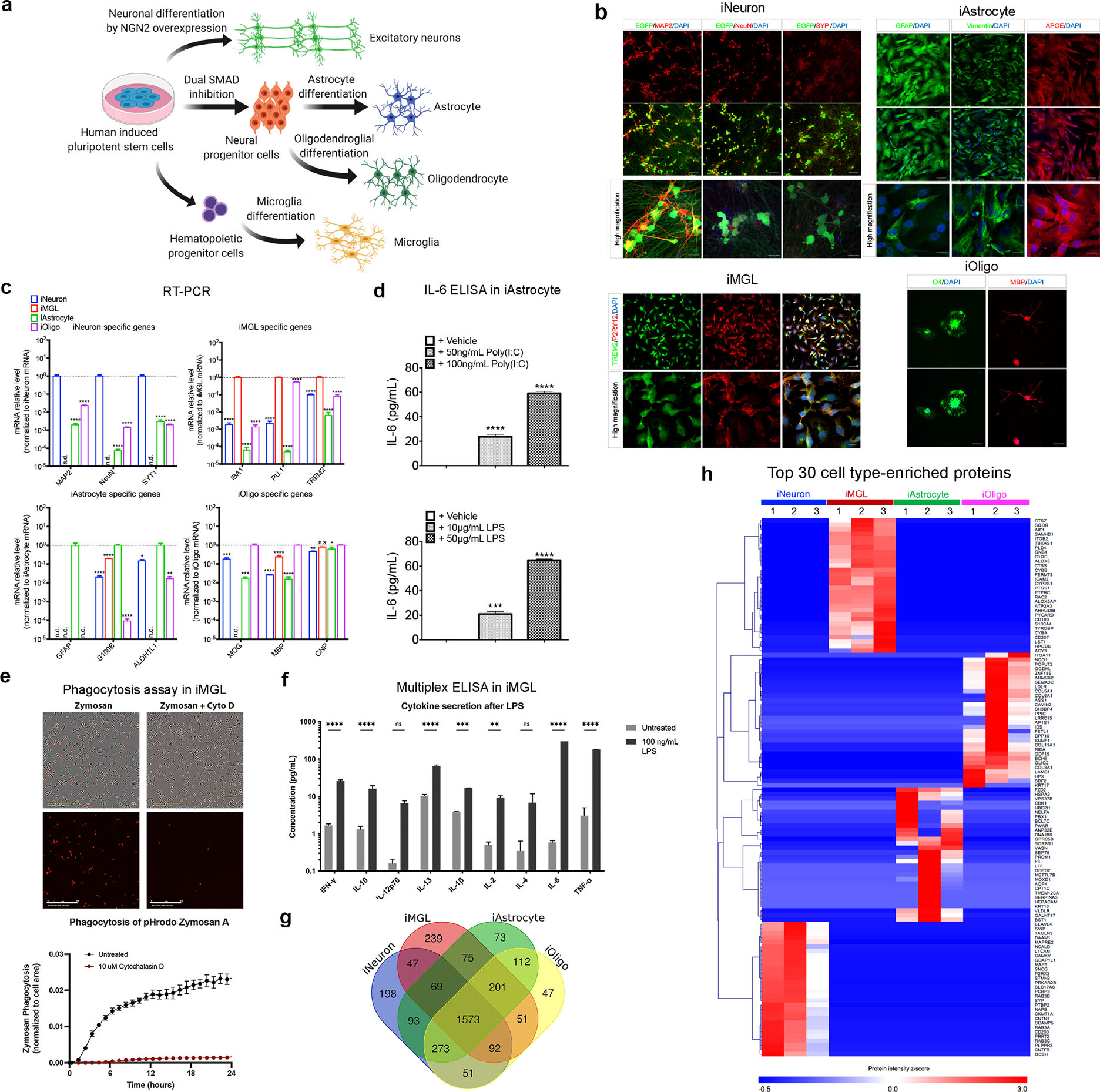
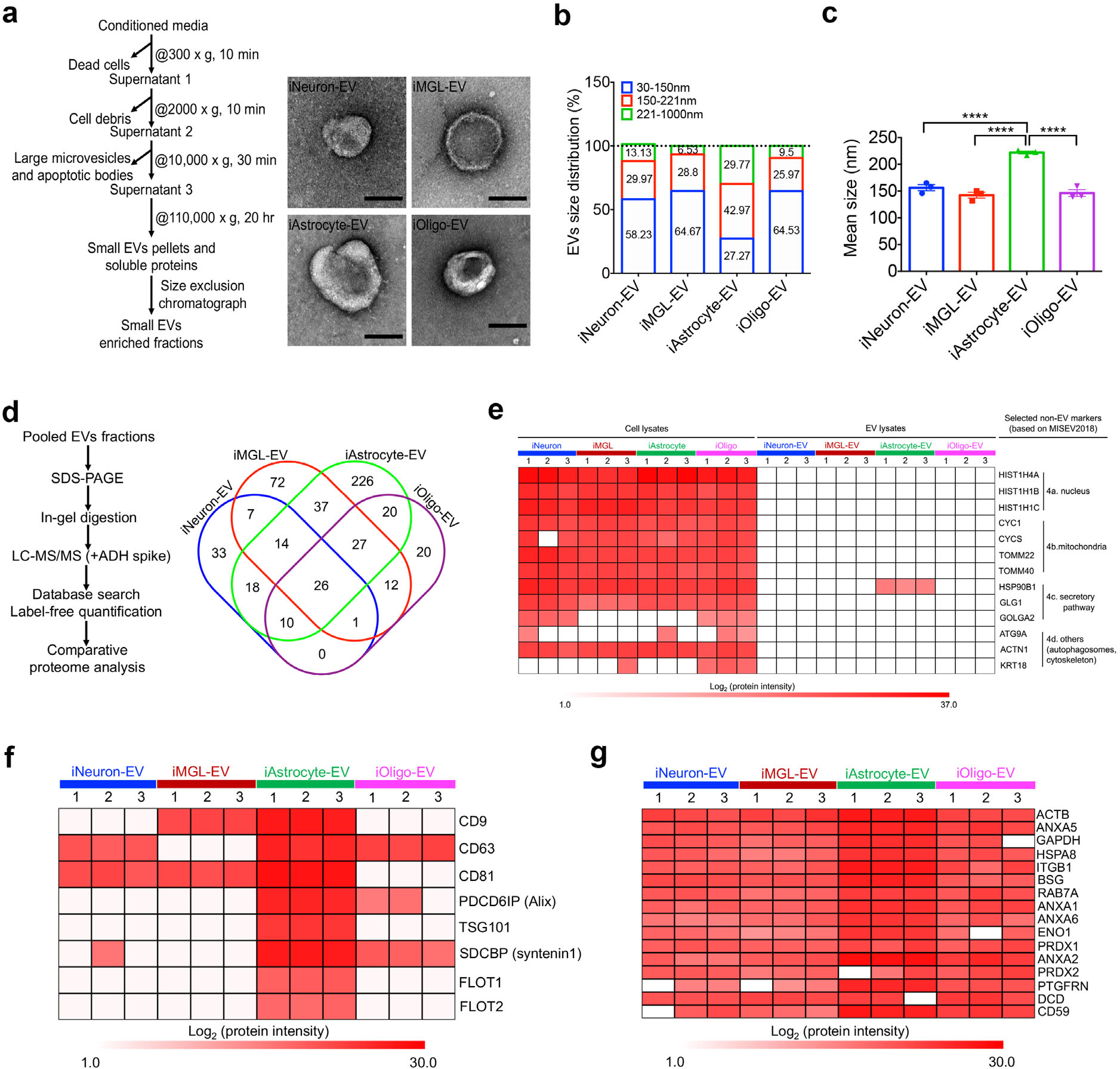
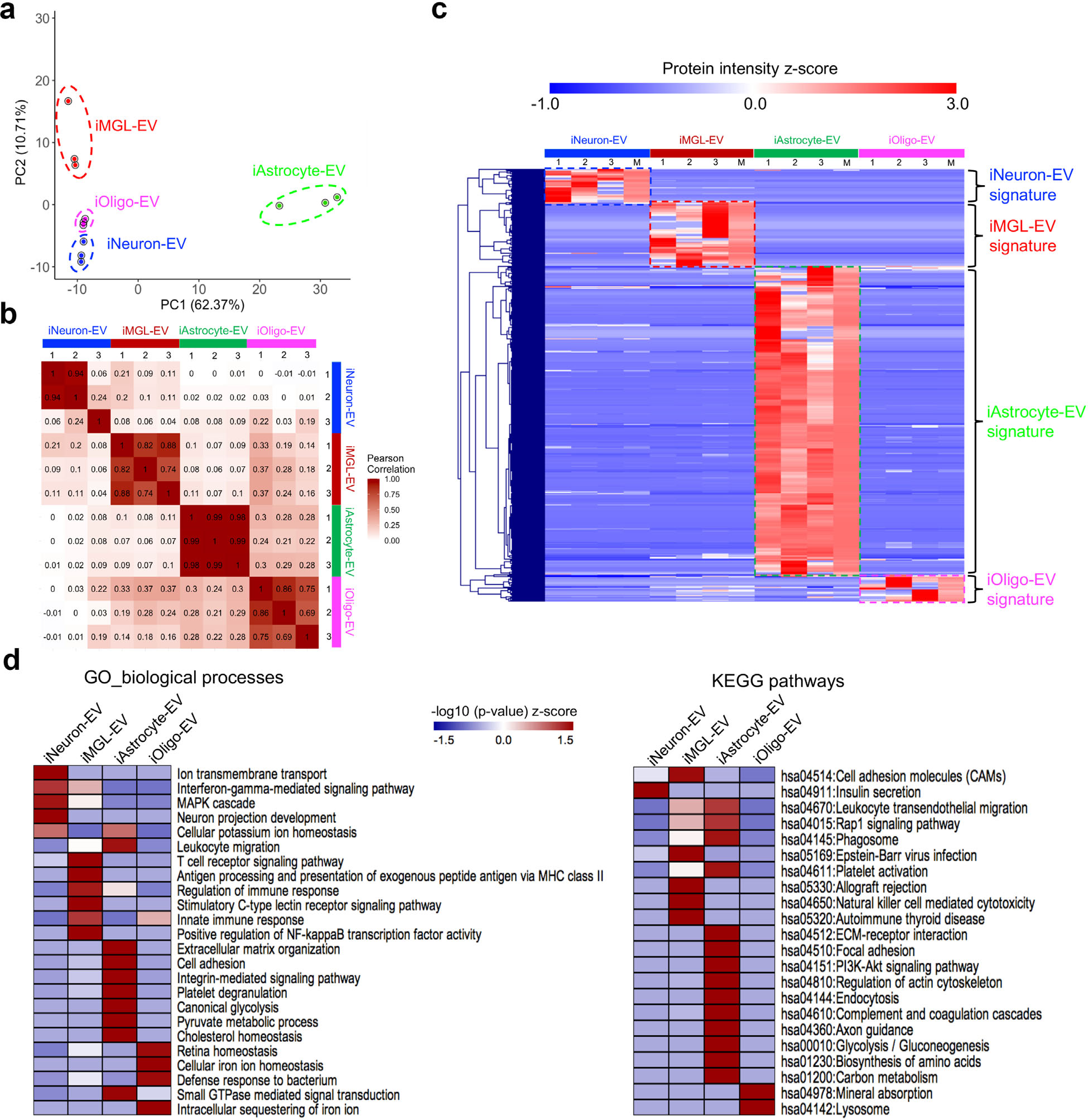
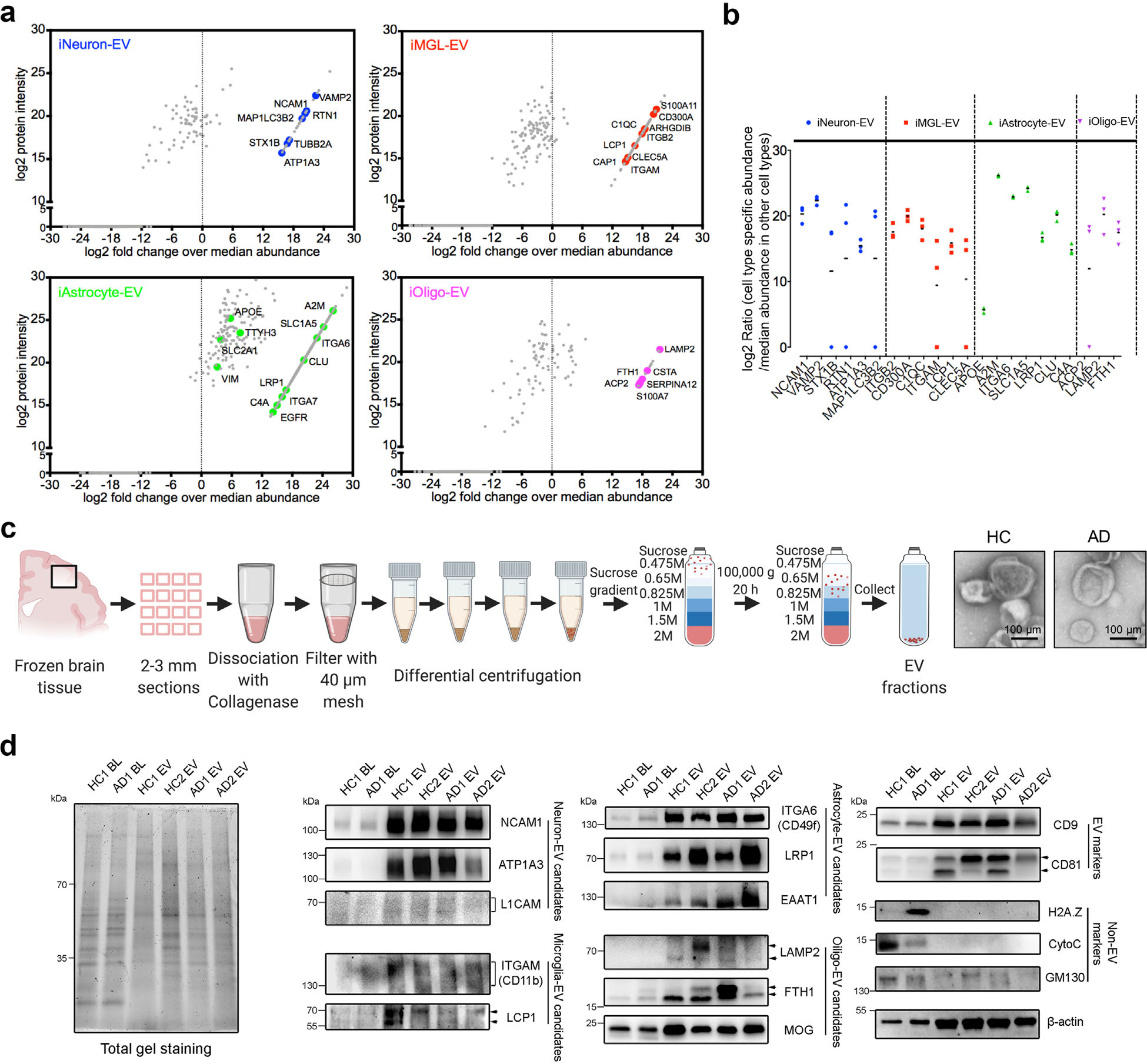
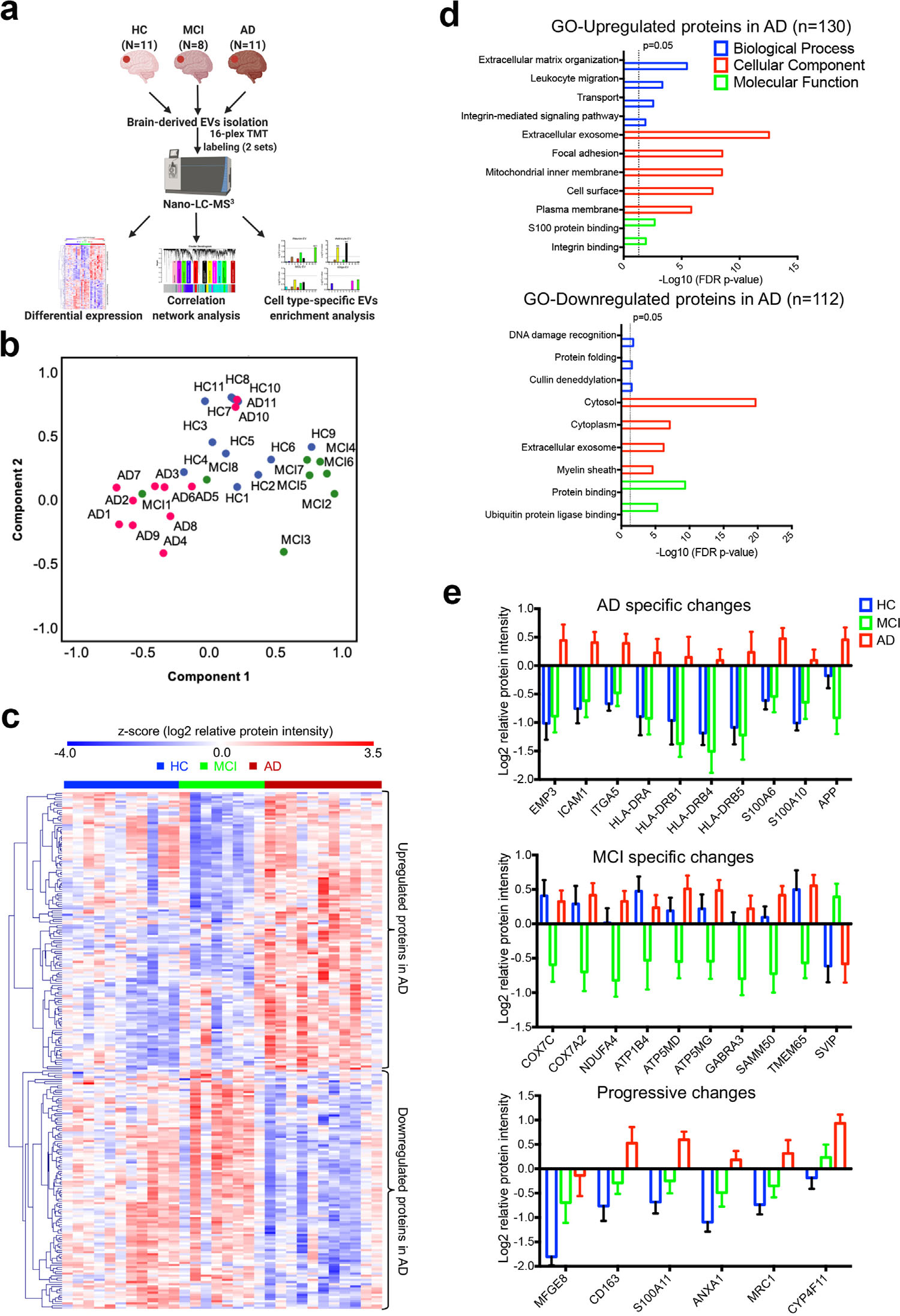
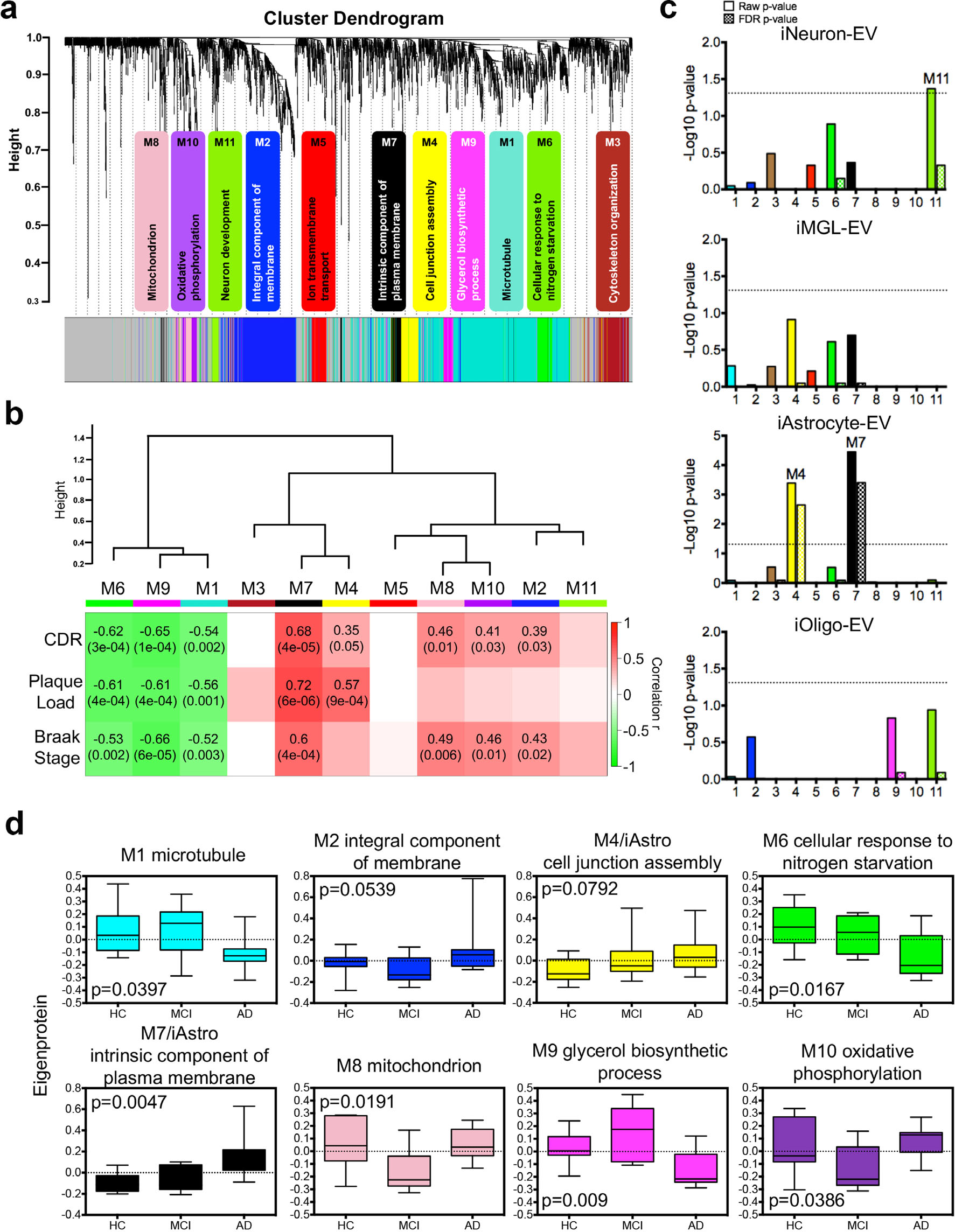
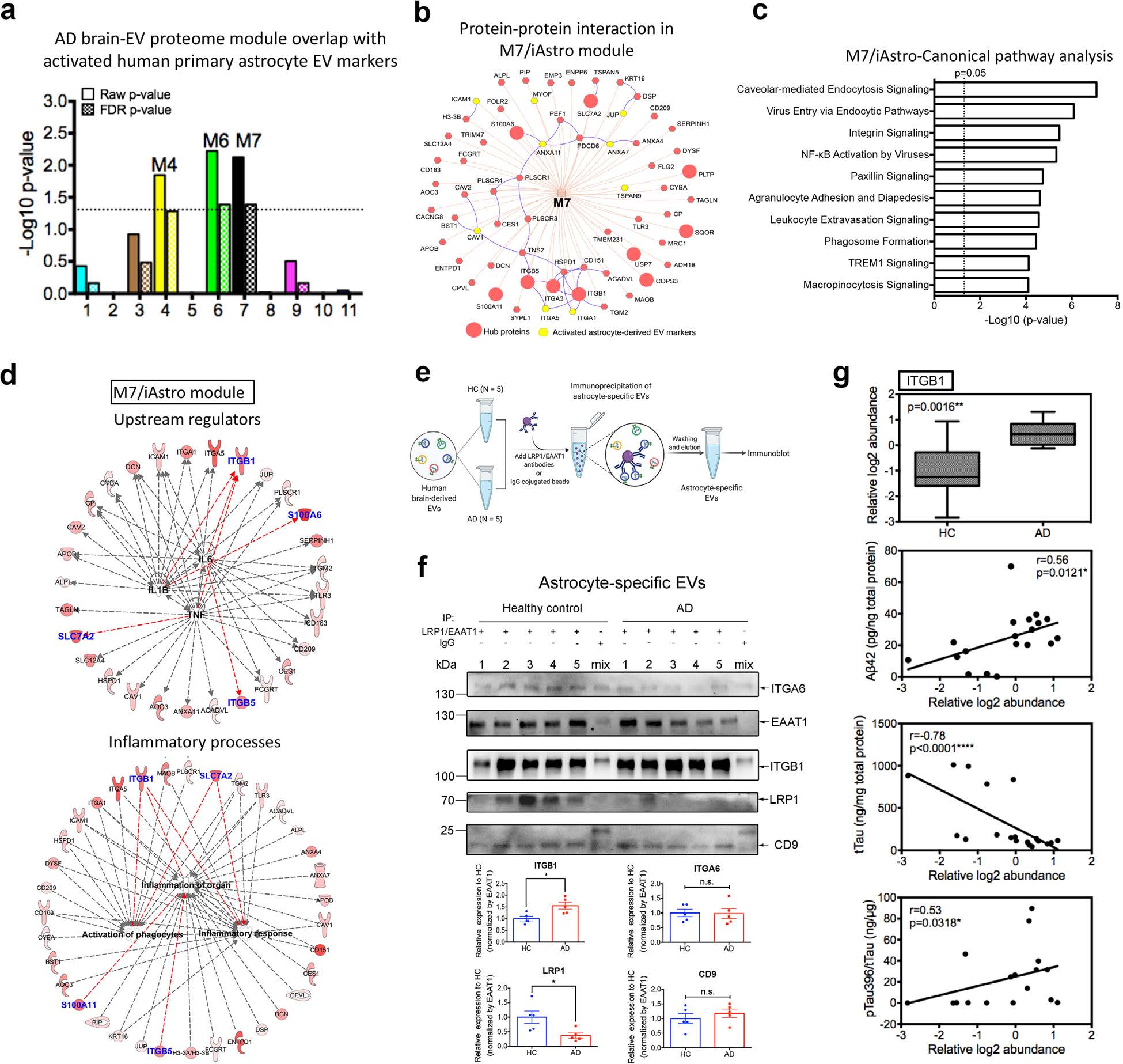
图7 M7模块在激活的星形胶质细胞来源的EV标记物中富集,并参与AD病理过程