m6A甲基化研究指南将从m6A是什么,m6A甲基化酶的种类及功能,m6A检测方法汇总,m6A课题设计思路,m6A论文发表梯度推荐,m6A后期验证工具大全到经典案例解析等方面为大家揭开m6A的神秘面纱,每天5分钟,就能从m6A小白入门到高阶提高哦~
今天的文章将围绕RNA甲基化m6A实验开展中几个重要的阶段进行介绍,一起来学习吧~
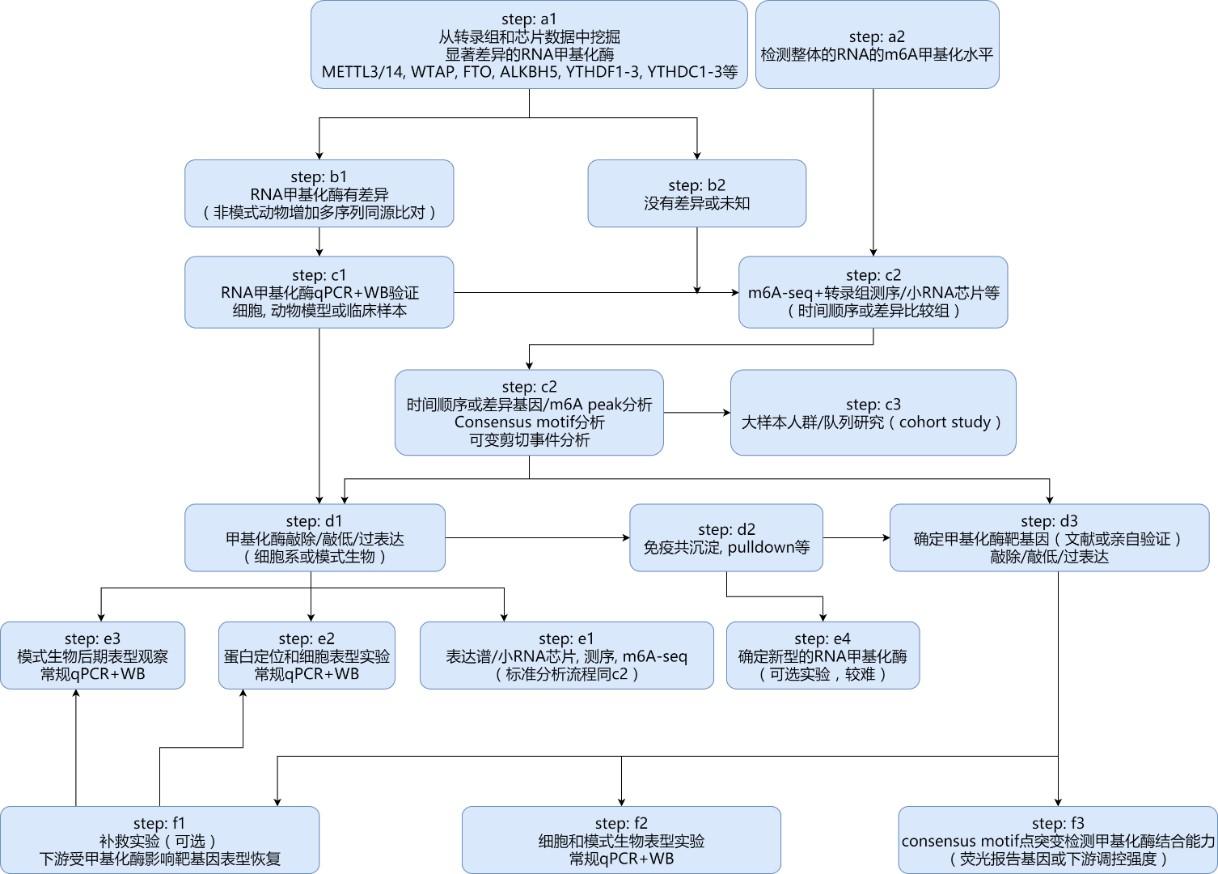
有很多老师和同学上次在后台留言说上面这张流程图,也就是m6A实验整体思路的流程图还是太复杂太抽象,不好理解。今天我们会来带领大家如何一步步开展自己的实验,身临其境地去体验m6A实验的每个阶段所要完成的步骤。
这篇文章会比较“啰嗦”和冗余,目的在于帮助刚踏入科研的同学们快速梳理自己的思路。如果老师有新的见解,也欢迎提出自己的想法与意见。
例如小陈是基础医学院直博二年级的研究生,研究方向为新型肿瘤药物。有一天小陈被导师喊去谈谈话交交心,导师语重心长地和小陈说RNA甲基化最近很火,让他看一下这个方向是否可以做一些尝试。
对于小陈而言,首先他要了解什么是RNA甲基化。简单地资料搜索后,他从Pubmed上下载了芝加哥大学何川教授和康奈尔大学Jaffrey教授撰写的相应综述,并对综述进行了详细阅读。因为这几位教授都是研究RNA甲基化的大牛,通过他们撰写的高质量综述可以避免很多弯路。
仔细研读综述后,小陈了解到RNA甲基化中的m6A首先在甲基化转移酶的作用下对RNA上的腺嘌呤(A)进行m6A修饰,再在去甲基化酶的作用下对已发生m6A修饰的RNA进行去甲基化修饰。最后发生m6A修饰的RNA通过被甲基化阅读蛋白识别后,行使下游的一系列功能,包括miRNA加工、mRNA出核翻译及剪切等。
下一步,小陈对几种参与RNA甲基化的酶进行了系统整理,将其分为Writers、Erasers和Readers。并将这些功能做了一个大致的罗列。

备注:整体时间花费在3-7天,推荐需要阅读和入门的参考文献:
Meyer, K., & Jaffrey, S. R. (2017). Rethinking m6A Readers, Writers, and Erasers. Annual Review of Cell & Developmental Biology, 33(1), 319.
Fu, Y., Dan, D., Rechavi, G., & He, C. (2014). Gene expression regulation mediated through reversible m6A RNA methylation. Nature Reviews Genetics, 15(5), 293-306.
Roundtree, I. A., Evans, M. E., Pan, T., & He, C. (2017). Dynamic RNA Modifications in Gene Expression Regulation. Cell, 169(7), 1187.
在对RNA甲基化进行初步扫盲后,就要进入下一步的研究了。这时候,需要开始大量的阅读m6A相关论文了,尤其是一些Research articles。这时候也要对经常在高分杂志屠榜的几个研究m6A的课题组烂熟于心。熟读他们的论文之后,还需要琢磨发高分的原因究竟在哪里?
通常来说,如果循着高手的足迹,对其实验思路进行me too似的修改,如换实验对象、换材料甚至是更换药物,充其量只能算是一篇copy论文,通常影响因子会下降不少,但是费用开销反而会增加不少。例如一篇PNAS或者NAR上发表的论文,如果按照其思路进行me too似的copy,文章档次会被卡死在6分左右。而6分左右的套路沿袭到自己身上,那么4分都很危险。
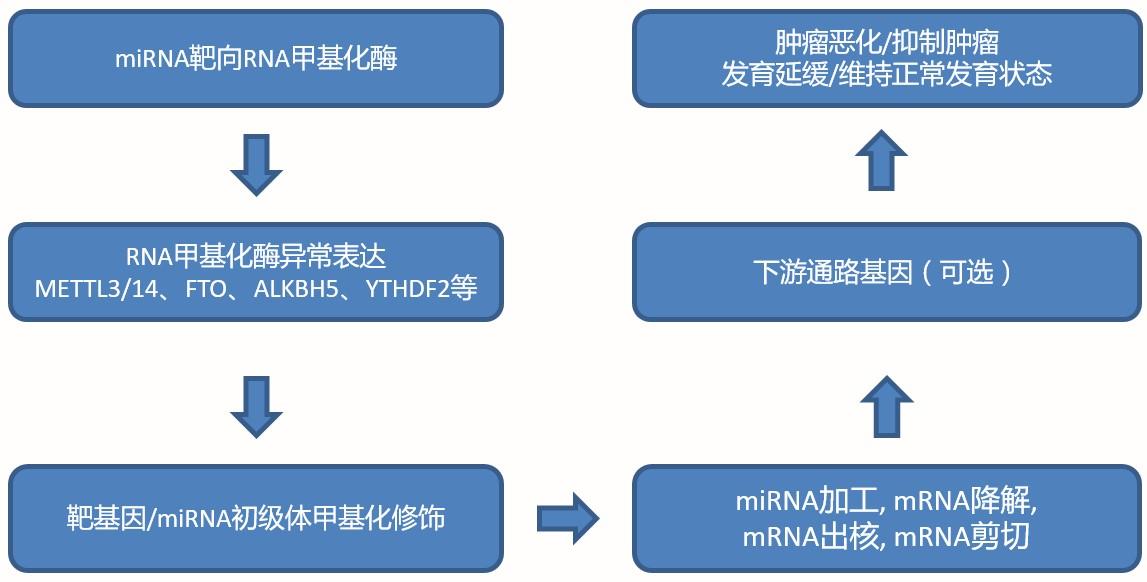
看到这张图请不要过于兴奋,尤其是miRNA抑制酶的转录水平,这种思路基本属于创新性较差的方向。而甲基化相应的酶调控miRNA就属于比较新的方向。其他的所有“套路”基本包含在这个流程图内。一切准备就绪后,就可以正式开启自己的RNA甲基化实验之旅啦!
阶段三所有实验为可选项,老师也可以跳过这部分直接进入测序部分,来挖掘哪些基因在甲基化修饰上产生了差异。
①找到差异writers、erasers和readers或者检测整体m6A水平
首先,还是要找到与RNA甲基化相关的酶是否有差异表达。既可以是药物处理前VS药物处理后,也可以是肿瘤组织VS癌旁组织,甚至是发育的时间顺序,非模式生物不同的组织器官做比较也是考虑的研究方向。
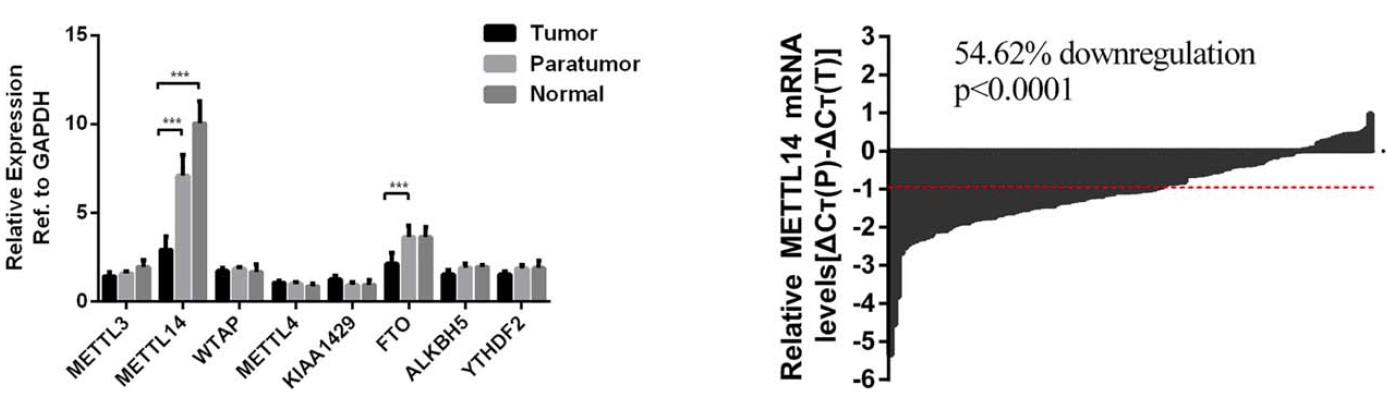
(Ma J et al. (2017) Hepatology, 62(2): 529)
如上图所示,作者对肝癌组织、癌旁组织以及正常组织中几种常见的酶都进行了qPCR验证,发现FTO和METTL14有差异表达。
另外通过GWAS以及各种人群大队列分析得到的易感基因正好和RNA甲基化有关,那么这项课题开展下去的意义会更大。这时候RNA甲基化被赋予了新的生命,是上游课题的延续。即全基因组重测序/全外显子测序/靶向捕获测序→SNP和Indel分析→GWAS→易感基因→细胞实验/动物实验→下游通路和分子机制→最终表型,整个课题会完整会丰满。
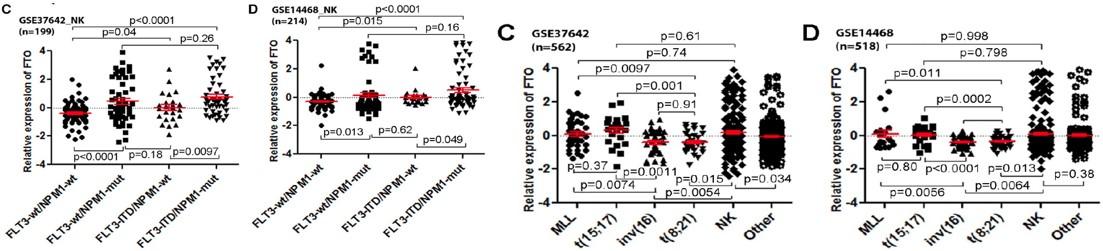
(Li et al. (2017) Cancer Cell, 31(1):127-141)
另一种省钱的方式就是从已发表的芯片数据中,直接挖掘几种酶是否有差异表达。如上图所示,何川教授和陈建军教授合作发表在Cancer Cell上的论文,前期就是从网上队列数据中筛选出FTO基因才继续进入下游的细胞实验和动物实验。
至于检测m6A整体水平,可采用LC-MS/MS或酶标仪比色法的方式进行。在医院酶标仪相对于LC-MS/MS普及程度更高,可采用EpiQuik m6A RNA Methylation Quantification Kit的试剂盒直接进行检测,方便快捷。
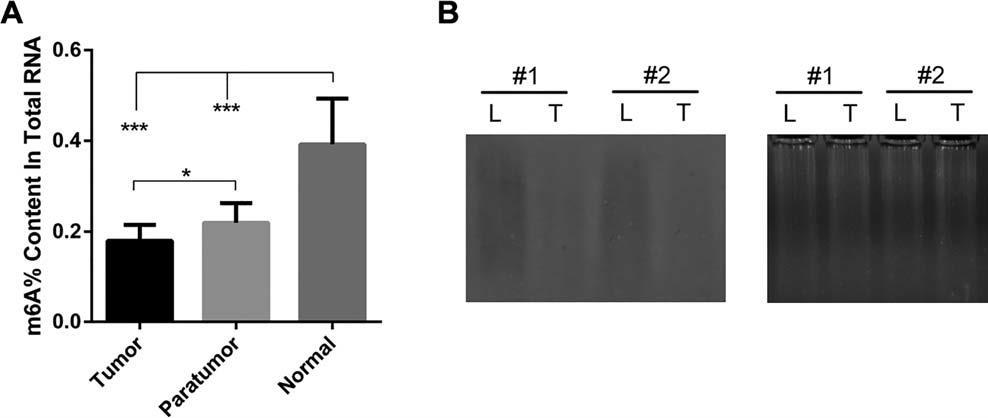
(Ma J et al. (2017) Hepatology, 62(2): 529)
如上图所示,作者对肝癌组织、癌旁组织和正常组织在酶标仪上进行了m6A整体的水平检测后发现,肝癌组织m6A整体水平最低,而正常组织中m6A水平最高。
此外,老师在细胞中对几种酶进行敲低和过表达后,也可以选择使用酶标仪来检测整体的m6A水平是否发生变化。
②甲基化酶敲低和过表达细胞实验
这里对几种已检测的甲基化酶进行敲低或过表达,当然这一步老师也可以在一开始直接进行。之后观察细胞表型和动物表型,建立起相关性关系。通常细胞实验比较容易开展,老师可以开始进行对应敲低/过表达体系的建立。
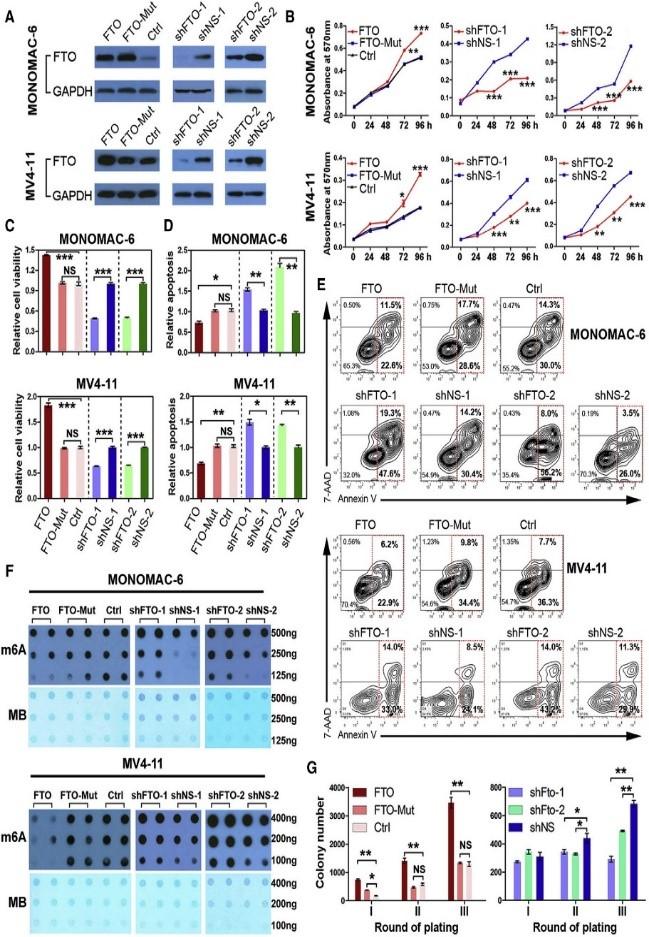
(Li et al. (2017) Cancer Cell, 31(1):127-141)
如上图所示,在急性髓细胞白血病AML中,FTO存在表达量显著上升现象。作者在AML细胞系中,对FTO这个基因进行敲低和过表达后发现AML细胞m6A整体水平降低,凋亡减少。敲低FTO趋势相反。
③甲基化酶敲低和过表达动物模型实验
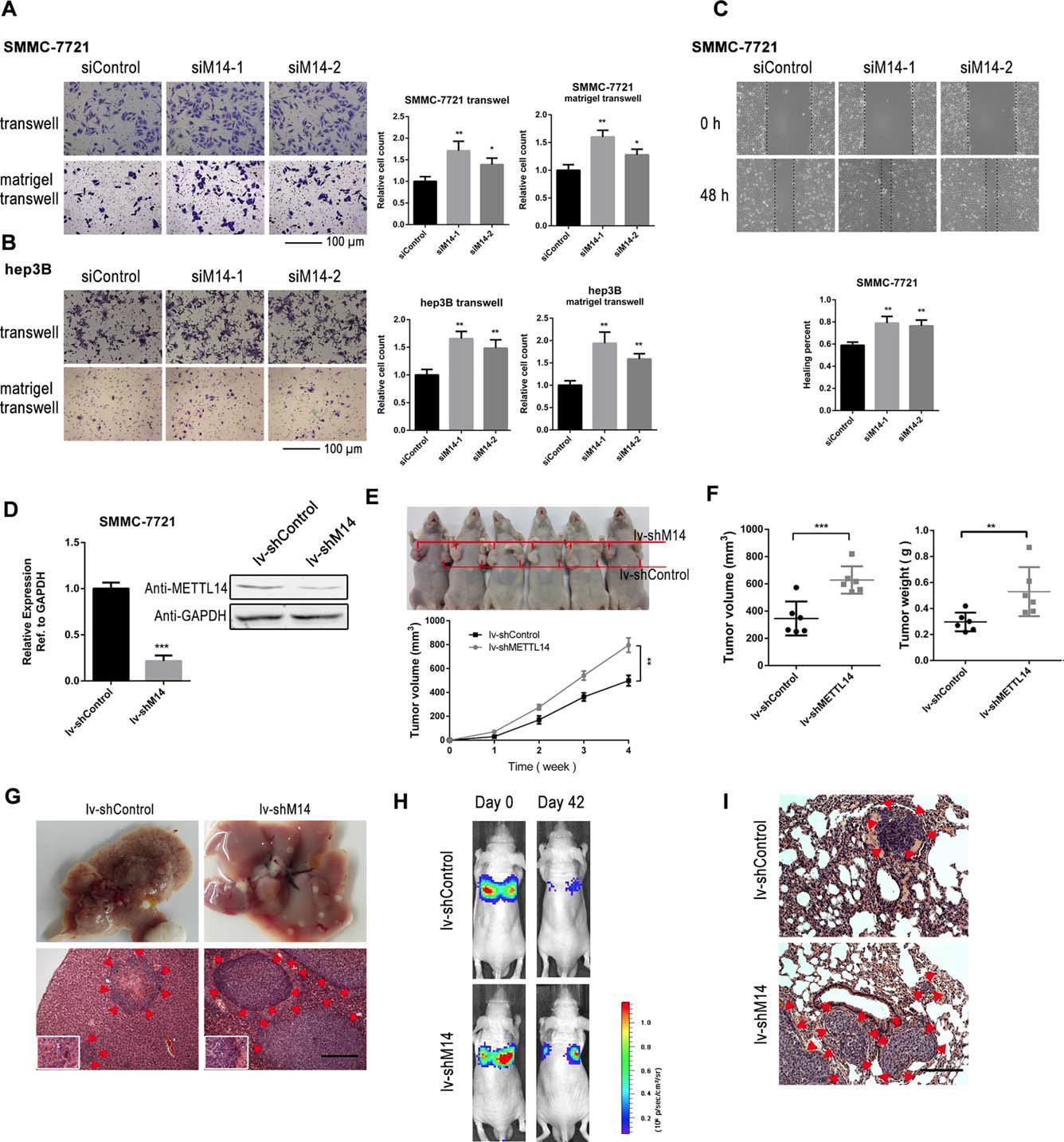
(Ma J et al. (2017) Hepatology, 62(2): 529)
动物模型通常为可选项,老师可以根据自己的经费和实验整体设计来安排。如上图所示,作者在小鼠肿瘤模型中对METTL14进行敲低后发现肝癌转移能力增强。
温馨提示一下哦~如有老师有对质粒载体以及病毒包装感兴趣欢迎联系联川生物,我们在前期已经对几十种酶进行相应过技术储备,能够随时向老师提供预实验服务。详情请咨询 market@lc-bio.com 或拨打电话0571-87662413。
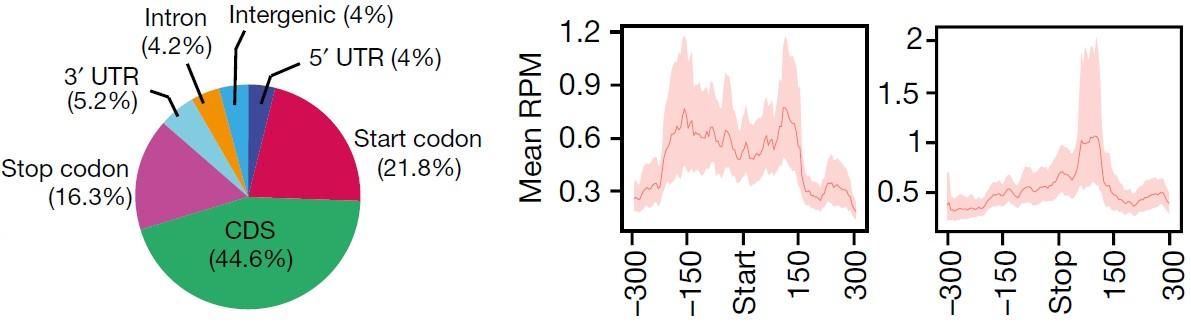
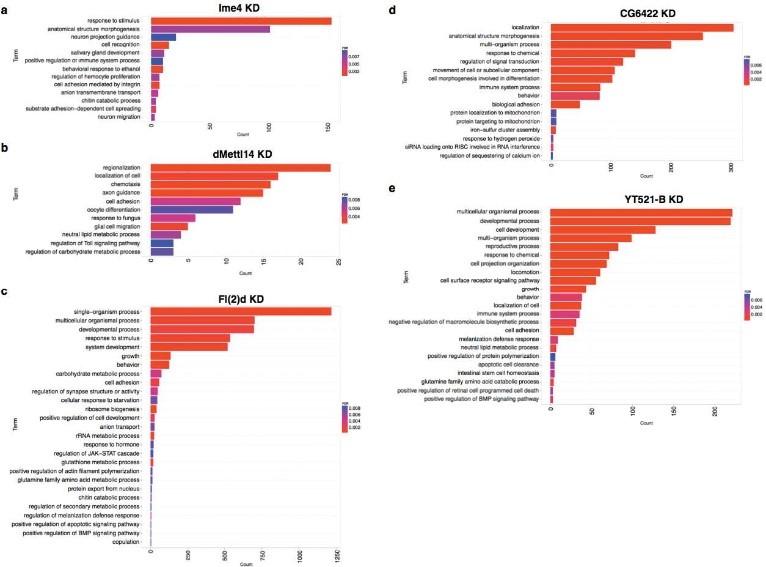
(Lence et al. (2016) Nature, 540(7632):242-247)
通过m6A-seq测序,老师可以知道究竟哪些基因在RNA甲基化修饰上有差异。如上图所示,作者对果蝇SR2+细胞进行m6A-seq和转录组测序后发现,差异基因都富集在神经功能上。
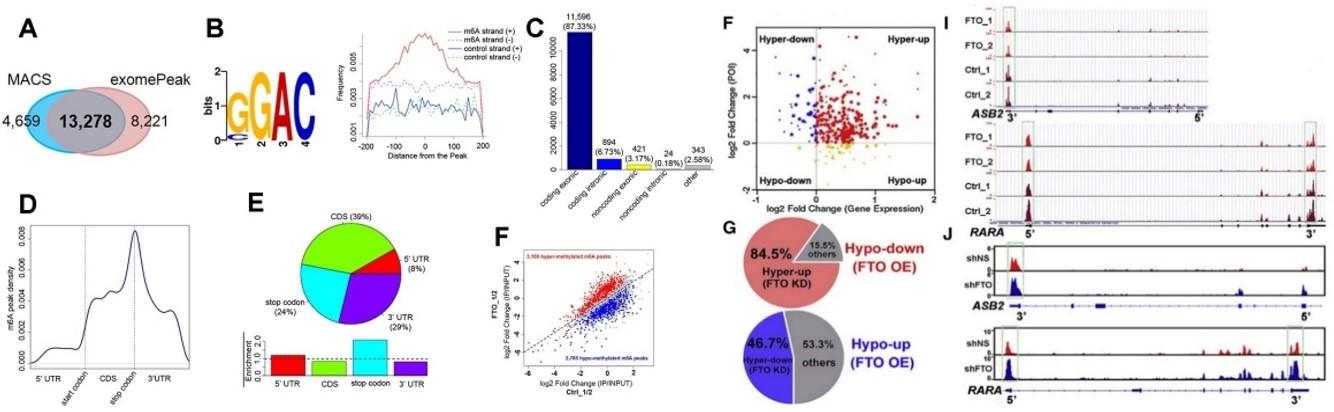
(Li et al. (2017) Cancer Cell, 31(1):127-141)
如果最后的差异基因或者存在甲基化修饰差异的基因过多怎么办?
这时候,老师可以结合自己先前课题的研究,在这些差异基因中寻找是否包含原有已知的通路和基因。如上图所示,通过m6A-seq作者在AML发现了几百个差异基因。初步筛选一般包括功能富集分析等方法。当几百个基因被限定到11个差异基因时,作者从中发现了RARA和ASB2这2个抑制白血病细胞生长的基因与全反式维甲酸相关。先前研究表明全反式维甲酸治疗后ASB2和RARA显著上调。这样子,在一大堆候选基因中,范围继续缩小。
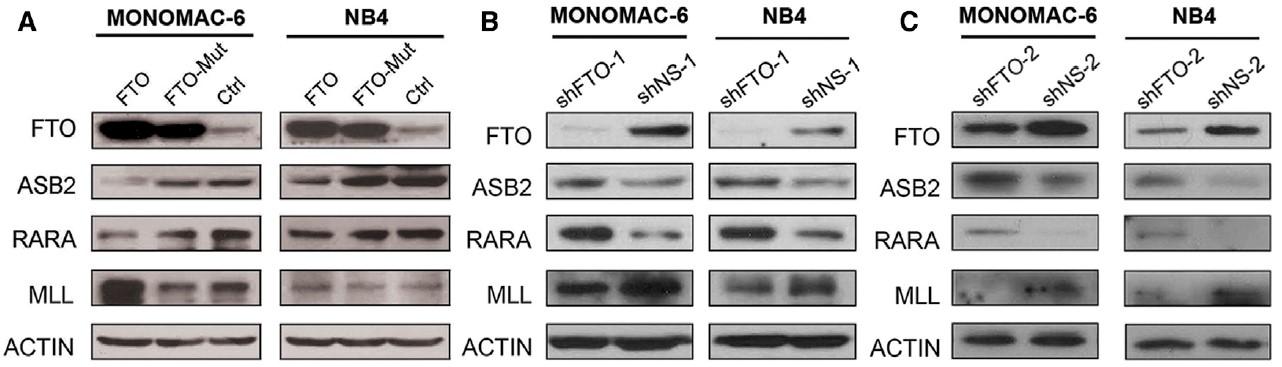
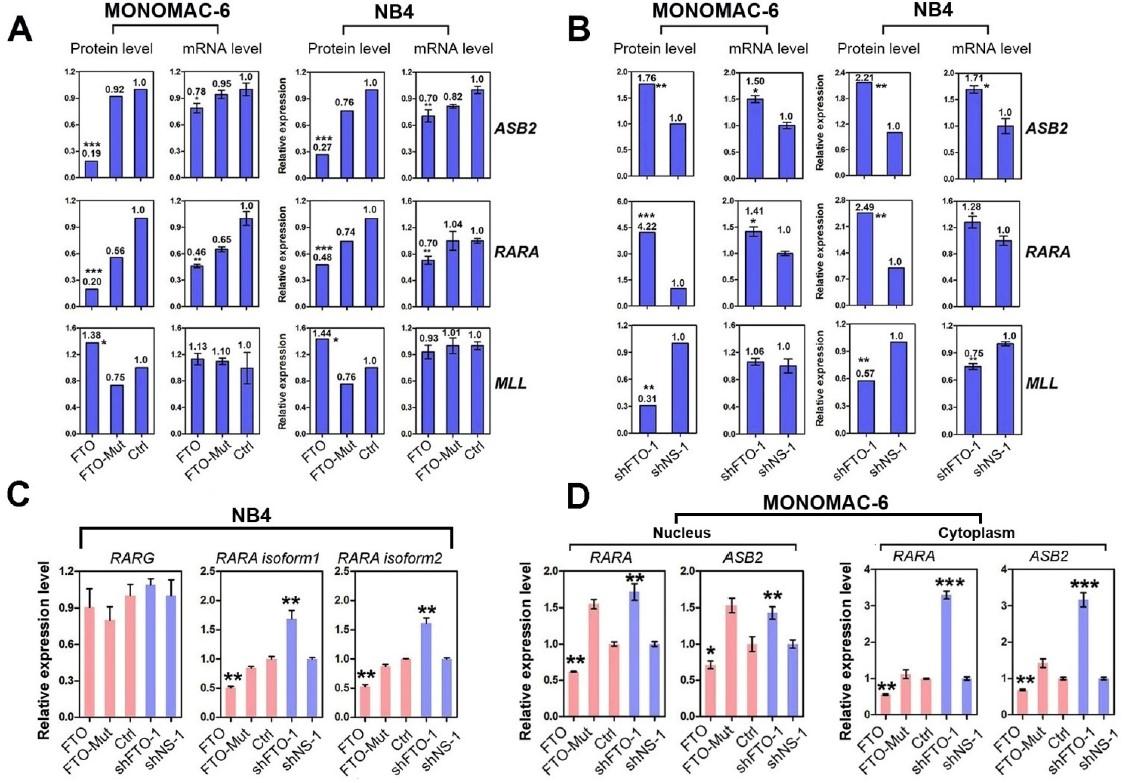
(Li et al. (2017) Cancer Cell, 31(1):127-141)
如上图所示,在确定ASB2和RARA为去甲基化酶FTO的靶基因后,除了常规的qPCR+WB验证外,作者还进行了补救实验(rescue)以及m6A-IP-qPCR(也叫MeRIP-qPCR)。作者用细胞实验对ASB2和RARA进行敲低并发现AML细胞表型与FTO过表达相似,表型被补救。
在经历了文献阅读、课题设计、测序前“预实验”、m6A测序及后续常规验证实验后,一篇合格的论文已经基本成型。这篇文章基本已符合6分杂志发表要求,下面我们再来介绍一下具体的实验和所需材料、试剂盒等。
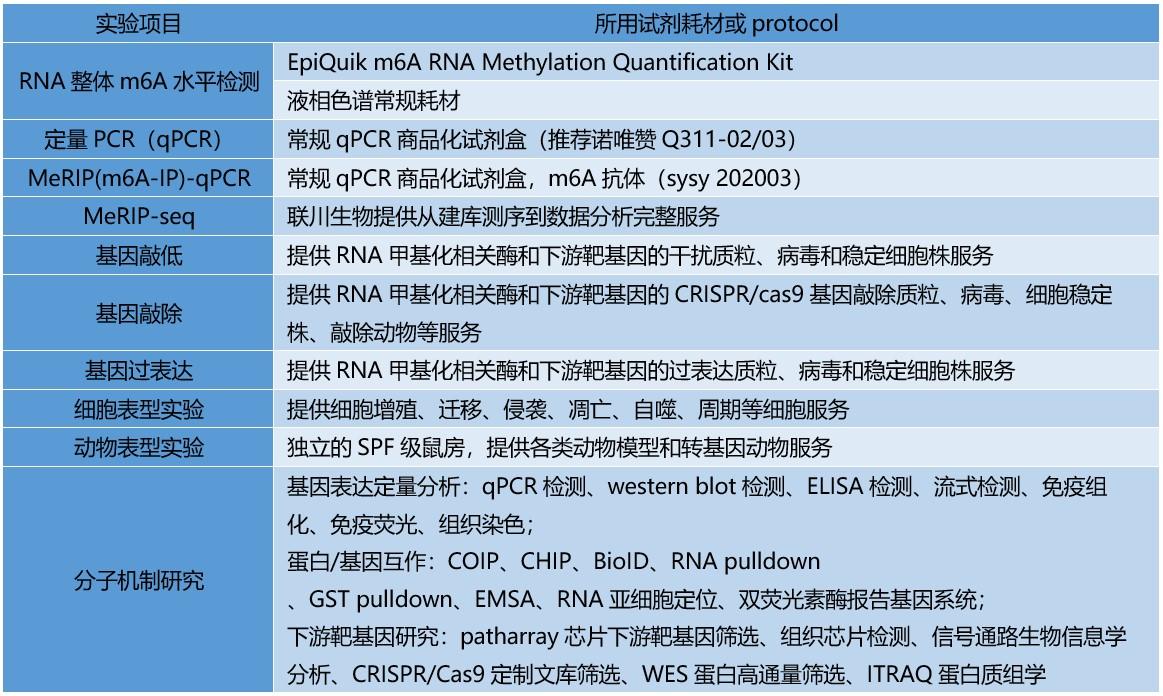
那么如何突破6分文章的瓶颈呢?通常高分文章在此基础上,会有两个大方向——临床和基础研究。
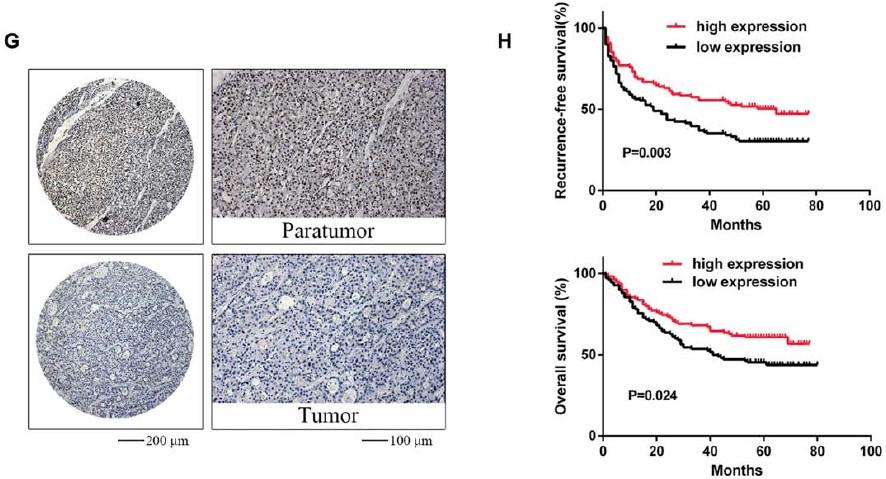
(Ma J et al. (2017) Hepatology, 62(2): 529)
在临床方面,通过上述实验挖掘到的甲基化酶或者是被调控的下游通路某一个基因或miRNA具有一定的临床意义会更加容易冲击高分文章。如上图所示,在HCC中METTL14低表达与转移侵染能力在表型上建立了相关性,METTL14在HCC中显著降低也与性别、乙肝病毒抗原以及微血管转移相关,METTL14与病人生存周期相关。所以作者最后得出结论,METTL14作为潜在的预后marker与HCC的转移相关。通过进一步分析发现,METTL14调控miR-126,而miR-126本身能够抑制肿瘤细胞的转移能力。那么在之前的基础上,挖掘到了更深层次的信息。
在基础生物学方面,可以通过Co-IP甚至是SILAC挖掘到与甲基化酶有互作的一些新蛋白并进行下游验证。或者可以购买几种酶的抗体进行RIP实验后,对富集到的RNA进行分析挖掘,找到几种酶有互作的RNA甚至是互作区域。接下来对特定的motif进行突变等实验进行验证。在这些实验完成后,如果能发现一种全新的机制一般容易冲击顶级期刊。
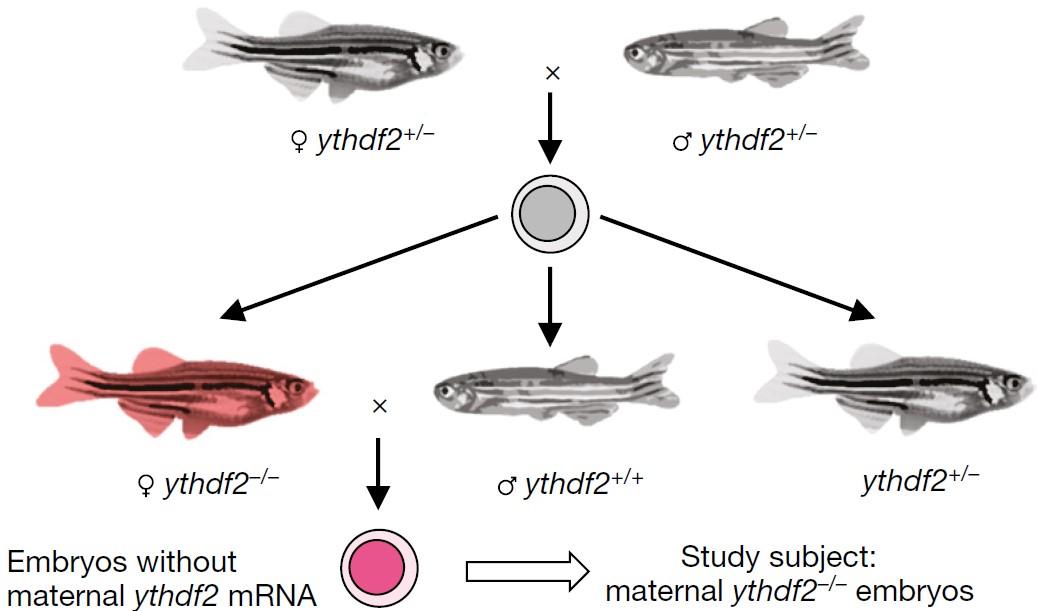
(Zhao B et al. (2017) Nature, 542 (7642): 475)
如上图所示,何川教授课题组在斑马鱼胚胎发育期间发现,如果母源的mRNA不被及时清除,容易在胚胎发育后期引起合子基因组激活受阻。其中整篇文章最重要、最关键的部分就是YTHDF2在识别带m6A甲基化修饰的母源mRNA后将其清除。这个现象从一种全新的机制来阐释,属于高度原创的工作,论文被Nature收录。
(
地 址: 杭州经济技术开发区下沙6号大街260号中自科技园16幢4层 联系人: 吴先生 电 话: 0571-87662413 传 真: 0571-81951905 Email:market@lc-bio.com
快来围观,你离高分paper还差一个phasiRNA
(2019-01-14T13:34 浏览数:10147)
如何选择合适的qRT-PCR内参基因?
(2019-01-14T11:06 浏览数:24508)
为什么要做绝对定量测序-数据分析
(2018-09-21T17:59 浏览数:9715)
低通量单碱基m6A验证的新方法|m6A专题
(2018-09-18T16:04 浏览数:9972)
祝贺联川客户继Nature后又发一篇Nature Genetics
(2018-09-18T16:03 浏览数:9584)
联川生物八月份客户文章汇总
(2018-09-18T16:02 浏览数:7968)
联川生物七月份客户文章汇总
(2018-09-18T16:01 浏览数:7790)
肝硬化与肝纤维化研究进展
(2018-09-18T16:01 浏览数:17823)
【用户案例】感染鲫鲤疱疹病毒2的银鲫中miRNA的差异表达
(2018-09-18T16:00 浏览数:8263)
病毒m6A专题 | HIV感染宿主促进病毒及T细胞m6A修饰
(2018-09-18T16:00 浏览数:9104)
联川生物技术公司
商家主页
相关咨询
