前言
“铁死亡”概念在 2012 年由 Dr. Brent R Stockwell 提出,它是一种铁离子依赖的细胞程序性死亡,生化特征区别于细胞凋亡、坏死、自噬。从机制上简单来说,在二价铁或酯氧合酶的作用下,催化细胞膜上高表达的不饱和脂肪酸,发生脂质过氧化,从而诱导细胞死亡,此外还表现为抗氧化体系(谷胱甘肽系统)的调控核心酶GPX4的降低。近年来,铁死亡引起了癌症研究界极大的兴趣,各种铁死亡相关的药物或疗法如雨后春笋,但是铁死亡究竟是如何作用于免疫系统,使用铁死亡疗法后对免疫微环境有何影响,这并不清楚。
近期VIB-UGent 炎症研究中心,Peter Vandenabeele研究团队于2022年7月在Nature Communications杂志上发表题目为“Cancer cells dying from ferroptosis impede dendritic cell-mediated anti-tumor immunity”的文章。该研究揭示了诱导铁死亡后,产生铁死亡的肿瘤细胞会对周围抗原递呈细胞产生抑制作用。

背景介绍
铁死亡,指的是一种依赖铁的细胞程序性死亡,其特征是出现细胞内氧化还原平衡被破坏和过度脂质过氧化。最近,铁死亡疗法已经成为一种新兴的抗肿瘤治疗方式,可以避免出现传统的耐药,达到清除已转移肿瘤的目的,目前,铁死亡疗法已经和纳米材料和脂质体等不同技术相融合,在肿瘤治疗领域大放异彩。
目前,对于铁死亡研究领域仍有空白,其中最关键的缺失之一便是,尚且不清楚肿瘤细胞铁死亡之后,对免疫系统有何影响,两者是如何“互动”,基于当下现状,有必要发掘铁死亡疗法与免疫治疗之间是否有协作可能。
在过去十年里,肿瘤细胞的免疫原性细胞死亡(Immunogenic Cell Death,ICD)已经化身为经典案例,成为了细胞程序性死亡研究的热点,免疫原性细胞死亡能够激起针对于特定肿瘤细胞的细胞毒性T细胞反应,达到根除肿瘤细胞的效果。但是,作者通过研究发现,铁死亡明显区别于其他程序性死亡方式,在诱导铁死亡后,可能会产生免疫耐受的现象。
亮点要素
1.铁死亡虽然能够使细胞因子和损伤相关的分子模式释放(Damage-associated Molecular Patterns,DAMP ),但是却无法激活抗肿瘤免疫应答。
2.通过条件性敲低的方式,构建了可以控制铁死亡进展分期的iGPX4KD细胞株,并通过实验发现,铁死亡早期亦或是铁死亡晚期的肿瘤细胞,均无法激活抗肿瘤免疫应答。
3.铁死亡早期的肿瘤细胞,能够影响DC细胞成熟,抑制DC细胞对于肿瘤细胞的吞噬。
4.DC细胞吞噬铁死亡细胞后,适应性免疫应答分子表达发现显著变化。
5.铁死亡肿瘤细胞能够抑制DC细胞的可溶性抗原的交叉递呈。
6.铁死亡不仅对肿瘤生长的抑制效应更弱,并且能够降低细胞凋亡引起的抗肿瘤免疫应答。
研究内容
01
作者首先选用了3种铁死亡诱导药物,分别对应早期、中期、晚期的三期铁死亡进展,并通过体内实验证明,当采用ML162药物诱导的铁死亡细胞作为肿瘤疫苗,并不能显著表现出抗肿瘤活性。而后,通过对于ML162、RSL-3、Erastin三种铁死亡诱导剂处理后的细胞上清进行分析,发现其中具有DAMP和CXCL1、TNF和IFN-β等细胞因子的释放。而对于钙网蛋白的调节,铁死亡诱导后虽然能够上调钙网蛋白的表达,但是与凋亡相比,铁死亡诱导的钙网蛋白高表达主要出现在一些死细胞的胞膜表面。
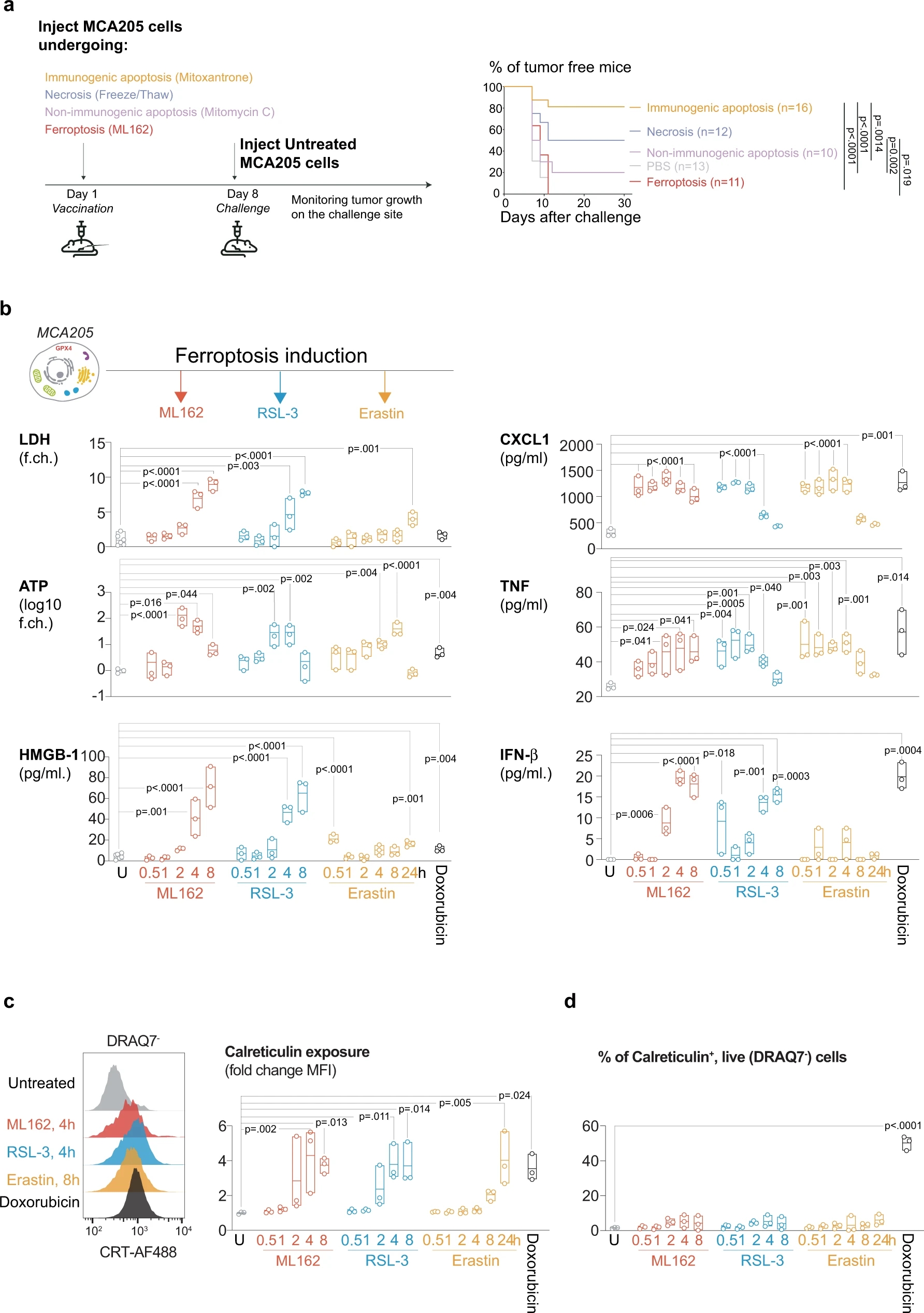
Fig. 1 Ferroptosis does not induce immunological protection against cancer cells despite the release of DAMP.
02
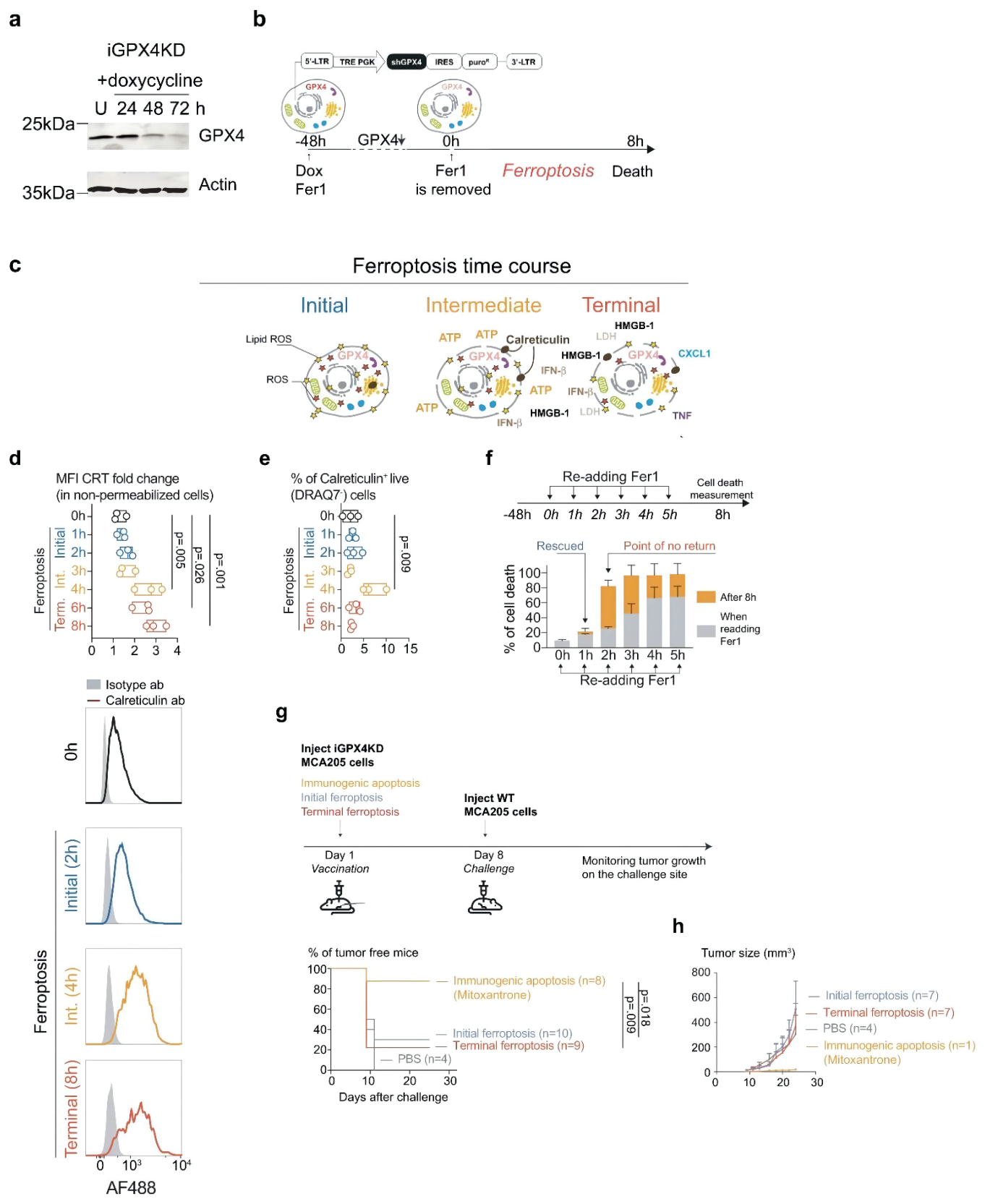
Fig. 2 Ferroptotic cells are not immunogenic regardless of the stage of cell death.
03
作者使用ML162、RSL-3、Erastin诱导肿瘤细胞铁死亡后,与DC细胞进行共孵育,发现均可以提高DC细胞的成熟度。为了细化实验步骤,他又用iGPX4的细胞模型进行双重验证,发现在肿瘤细胞发生铁死亡早期,不仅不能促进DC细胞成熟,反而会抑制DC细胞的活力。另外暴露了一个很有意思的现象,ML162诱导的早期铁死亡,能够抑制DC细胞对于细胞因子的释放,这是铁死亡细胞明显区别于UV诱导细胞细胞凋亡的区别。除此以外,铁死亡区别于凋亡,当细胞存活时,磷脂酰丝氨酸并不会外翻,影响DC细胞对于肿瘤细胞的识别。而DC细胞与早期铁死亡细胞共培养后,也会导致DC细胞脂滴堆积,影响DC细胞功能。
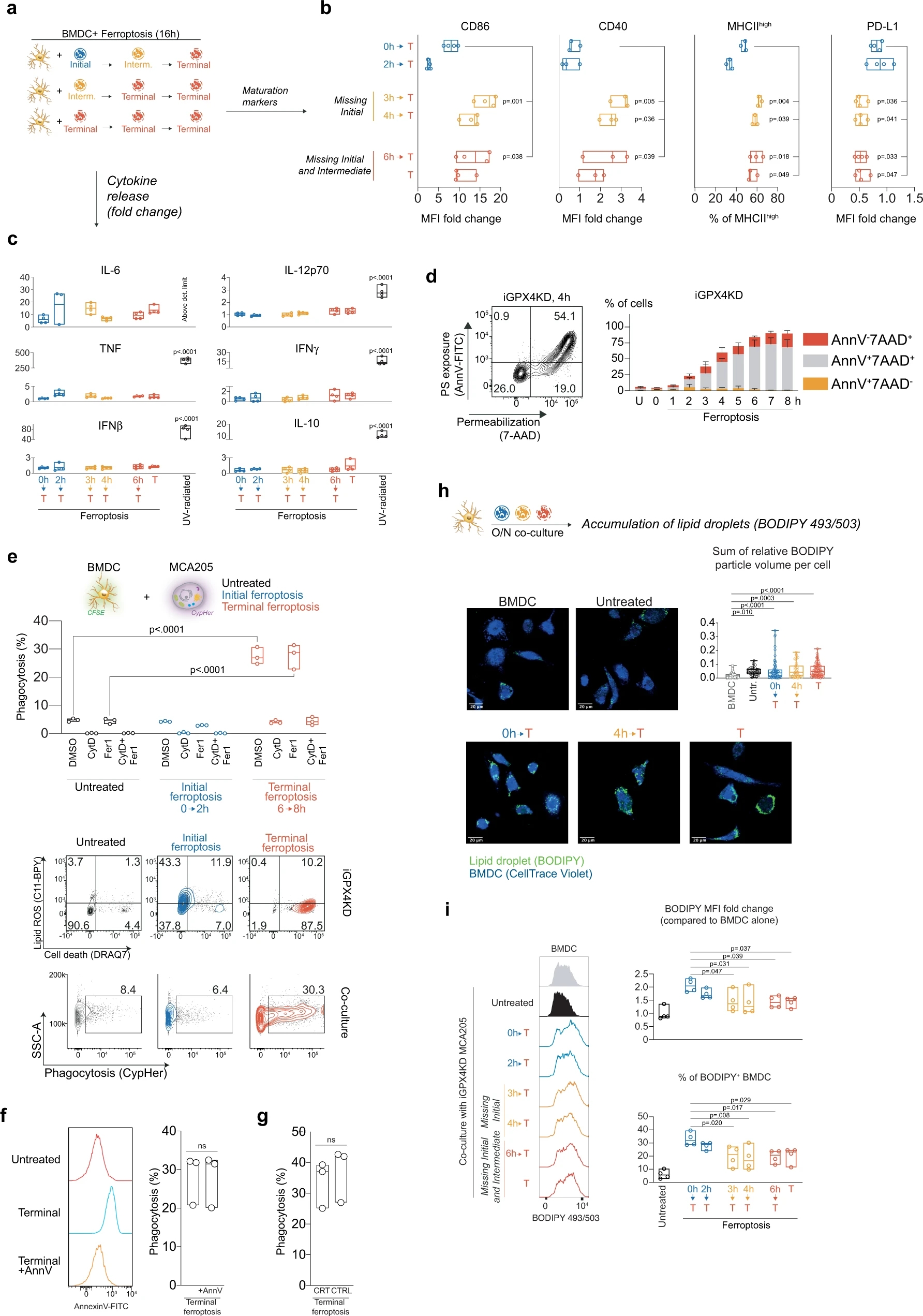
Fig. 3 Initial ferroptosis impairs the maturation of dendritic cells.
04
作者将带有荧光的Jurkat细胞进行铁死亡诱导,后跟BMDC细胞进行共培养,通过流式分选的方式,筛选吞噬铁死亡细胞后的DC细胞,进行转录组测序,结果表示,吞噬铁死亡细胞后,DC细胞中与适应性免疫反应相关的基因受到了明显影响,如NFKB家族基因,趋化因子和细胞因子等。综合整体变化,发生铁死亡的肿瘤细胞对DC细胞的抗原递呈能力有显著影响。
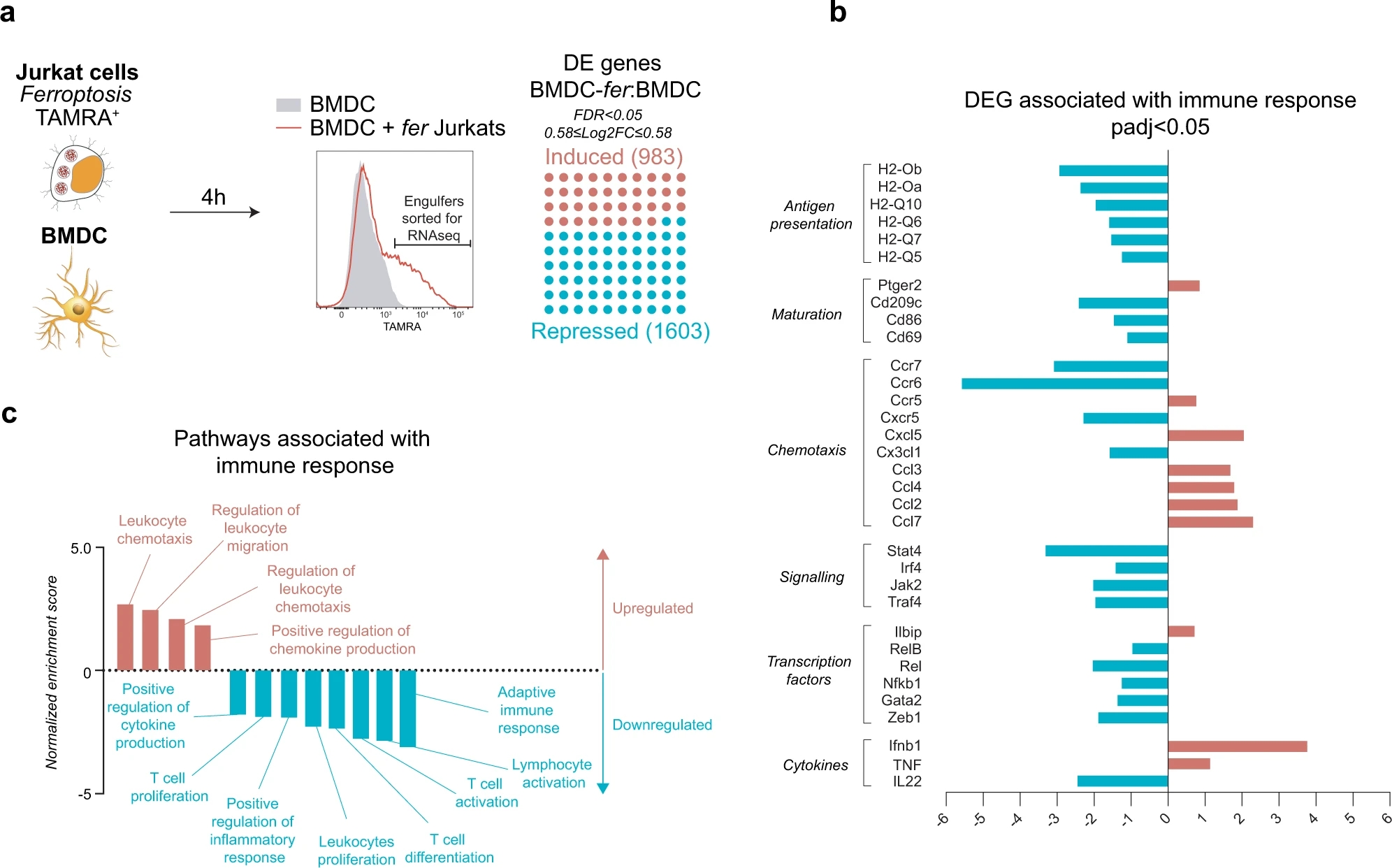
Fig. 4 Engulfment of ferroptotic cells by DC suppresses expression of genes associated with adaptive immune response.
05
抗原交叉递呈,指的是MHC 分子对抗原的提呈存在交叉提呈现象,即MHC I 类分子也能提呈外源性抗原,而内源性抗原也能通过MHC II 类途径加以提呈。作者通过DC细胞吞噬铁死亡细胞,并将DC细胞与OT1小鼠(该CD8+T细胞能够特异性识别OVA抗原)的CD8+T细胞进行共孵育,发现会抑制T细胞的增殖,即铁死亡细胞的外源性抗原影响DC细胞MHC I对于CD8+T细胞的激活。

Fig. 5 Ferroptotic cells impair dendritic cells ability to perform antigen cross-presentation.
06
首先,作者使用过表达OVA抗原的小鼠胚胎成纤维细胞作为疫苗,先进行免疫反应后再进行皮下成瘤,发现铁死亡与凋亡和坏死相比,几乎完全没有起到预防肿瘤增殖及延长荷瘤小鼠生存期的作用。他换了一种方式,使用了负载OVA抗原的cDC1细胞进行皮下注射,证明仍然无法对肿瘤生长起到有效影响。最后,作者使用米托蒽醌诱导细胞凋亡,发现当加入铁死亡细胞与凋亡细胞进行共同免疫时,能够显著抑制由凋亡细胞疫苗带来的抗肿瘤效果,至此,本项研究全部结束。
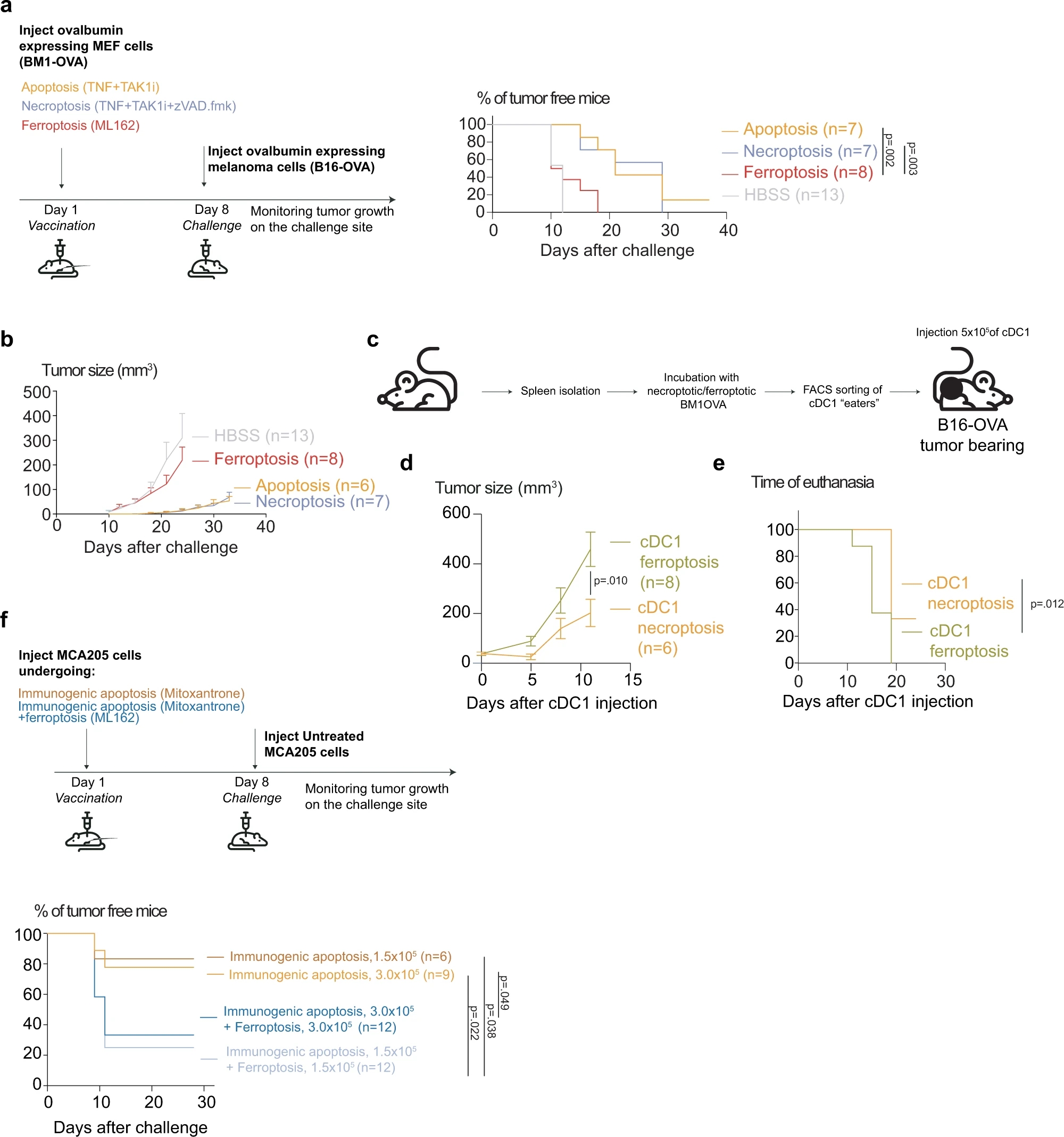
Fig. 6 Ferroptosis is less potent in controlling the tumor growth compared to apoptosis and necroptosis and diminishes the immunogenicity of apoptosis.
结尾
文章证明,铁死亡并不像我们假想的那样,是一种免疫原性细胞死亡,恰相反,肿瘤细胞出现铁死亡现象之后,能够从DC细胞成熟、细胞因子及趋化因子分泌、抗原递呈功能等多方面抑制抗肿瘤免疫反应。该项研究探索了铁死亡与肿瘤免疫之间的混沌区,尤其在体外研究DC抗原递呈及免疫杀伤的技术手段,值得我们深入学习探讨。

和元生物具有多年丰富的肿瘤方向体内及体外的实操经验,并兼具出色的基因操作与病毒构建等技术。同时依托公司的检测平台、病理平台、细胞平台、动物平台等专业实验平台,可为您提供从测序、分子构建、细胞功能学检测、动物实验及病理检测等一站式肿瘤研究服务体系,您可体验文中涉及到的前沿研究手段与支持。欢迎关注和元公众号了解实验服务详情,和元生物期待您的到来。
