7月5日,科济药业临床开发副总裁汪薇博士在细胞治疗系列公开课【第7期】中做了主题为《细胞治疗的临床研究》的报告,本文根据专家报告内容整理,并经专家审核确认。

嘉宾简介汪薇博士,科济药业临床开发副总裁汪薇博士于2018年加入科济药业,负责细胞治疗和单抗产品的临床开发工作。加入科济之前,先后在默沙东、诺华和辉瑞公司的临床科学、医学事务、药物安全等部门工作,有着丰富的临床开发工作经验。获得了中南大学儿科学硕士和复旦大学儿科学博士学位,曾在中南大学湘雅医院医院工作6年。
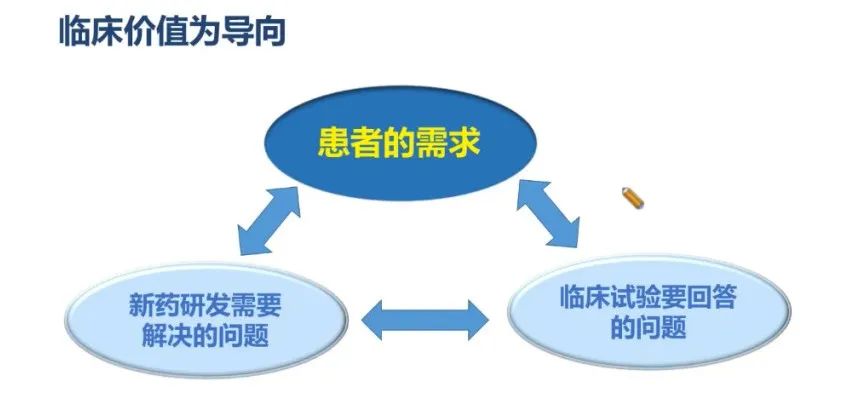
临床研究要以临床价值为导向
新药的临床研究工作应从临床价值为导向出发,围绕患者需求进行药物研发。应基于患者需求寻找新药研发需要解决的问题,并通过临床试验回答相应问题。患者的需求、新药研发需要解决的问题和临床试验要回答的问题,这三者是三位一体的,缺一不可(图1)。 临床药品开发做的一切工作,其实都是基于患者的需求。新药研发需要解决实际的问题,也就是要解决患者面临的问题,并且通过临床试验来验证新药对患者的安全性和疗效以及其他的特征。这是以临床价值为导向来做临床研究的一个整体思路,细胞治疗的临床试验同样也是基于这样的思路进行设计和研究。
CAR-T细胞疗法简介
2011年,小女孩Emily作为全球第一个接受CAR-T细胞治疗并被治愈的患者,现已无癌生存了10年,是CAR-T细胞治疗最经典的案例。从1989年第一种CAR-T细胞问世,到2017年,第一款CAR-T细胞产品批准上市,CAR-T细胞治疗经历了近30年的发展(图2),它与传统的药物相比有很多独特之处。
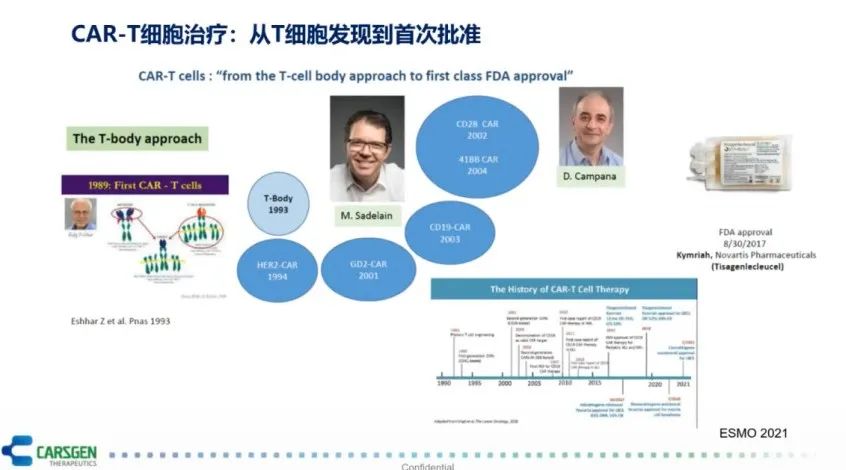
图2 CAR-T细胞治疗的研究历程
从CAR-T细胞治疗机制来看,它是一个经过基因改造的活细胞。从患者身体中提取细胞后经过实验室的改造,生产制备扩增以后,再回输到患者体内。在体内,CAR-T细胞识别抗原、激活细胞免疫,从而杀死肿瘤细胞。 因而,CAR-T细胞疗法的确有着传统药物不可比拟的优势。它具有治愈肿瘤的潜力,能够克服耐药并有完全根除肿瘤细胞的潜能;CAR-T细胞作为活细胞,能够在体内增殖,可在体内维持并持续有效长达数月;CAR-T细胞疗法具有很强的适应性,它能够适应多种肿瘤相关靶点与不利的肿瘤微环境,且具有更有效的抗肿瘤疗效而避免其他昂贵的治疗方法,CAR-T细胞疗法可能就是一种单次或者两到三次的治疗,极大改善患者治疗的便利性(图3)。

03
细胞治疗的现状
虽然CAR-T细胞疗法从第一个产品上市到现在也不过是五年的时间,但正是因为CAR-T细胞具有传统药物所不可比拟的一些优势,不管是从商业化、新药审批上市和临床试验的开展,CAR-T细胞疗法都在不断发展并取得了长足的进步。到目前为止,美国已经批准了6款CAR-T细胞治疗产品,在中国也已批准了2款CAR-T细胞治疗产品。最近在美国获批的基于BCMA靶点的CAR-T细胞疗法是我们中国人的骄傲,因为它是中国公司南京传奇自主研发的产品,这也是中国CAR-T细胞疗法的里程碑(图4)。CAR-T细胞疗法在美国获得更多的适应症,这也表明它在中国有更大的成长空间。

尽管CAR-T细胞是细胞治疗研究中的明星细胞,是细胞治疗临床试验最多的一类细胞。然而,正处于蓬勃发展的细胞治疗还涵盖了如B细胞、NK细胞、巨噬细胞、TCR-T等,也正在进行大量的临床研究(图5)。截止到2022年4月15日,细胞治疗的临床研究共计达2755项。其中,CAR-T细胞独占鳌头,占比达50%。此外,相比于去年,CAR-T细胞临床试验研究数量增长了24%,而增幅最大的是NK细胞治疗,高达56%。
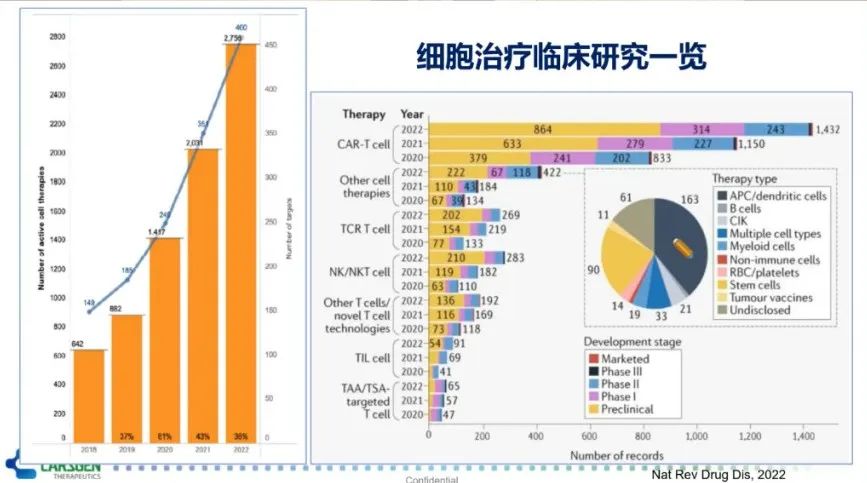
细胞治疗在研的靶点主要分为血液瘤和实体瘤两大类。其中,血液瘤方面的靶点分布与以往相似,主要集中在CD19、BCMA、CD20和CD22这些常见靶点。临床试验增幅较大的靶点有GPRC5D(200%)、CLEC12A(114%)和CD7(78%)等。实体肿瘤中常用的靶点有HER2、间皮素(MSLN)和GPC2/3等。但备受瞩目且也是增幅最大的,当数CLDN 18.2,增幅达400%。此外,CD276和KRAS这两个靶点的临床试验增幅也达到了160%和125%(图6)。值得注意的是,这里边有相当多试验是来自于中国研究者和中国公司的贡献。

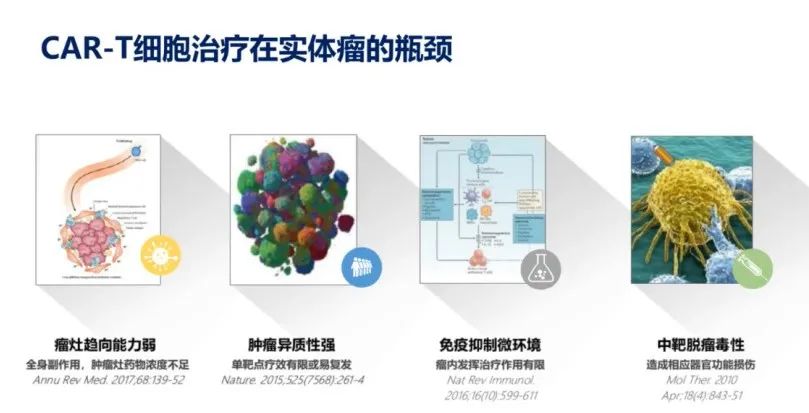
相较于近年来CAR-T细胞疗法在血液瘤治疗中取得的突破,CAR-T在实体肿瘤中的治疗尚处于早期探索阶段,还有很长的路要走。在实体瘤治疗中CAR-T细胞仍存在诸多瓶颈(图7):瘤灶趋向能力弱,伴随着全身副作用,如中靶脱瘤毒性;实体肿瘤的高度异质性使得单靶点疗效有限并易复发;此外,肿瘤免疫抑制微环境使得瘤内发挥治疗作用有限。
因此,在CAR-T细胞技术开发过程中的关键在于选择一个好的靶抗原。靶抗原的选择原则在于:疗效最大化,毒性最小化。CAR-T在血液瘤治疗应用中取得的成绩离不开其对靶点的选择,如CD19和BCMA都是非常好的天然靶点。在实体瘤治疗中,大家在靶点筛选上做了很多的探索性工作。其中,最近发现的CLDN18.2这个靶点得到非常多的关注,正如前面所提到的临床试验项目数呈400%的速度增加。 CLDN18.2作为消化道肿瘤的一个特异性靶点,未来是很有可能成药的。科济药业开发了基于CLDN18.2靶点的CAR-T细胞进行治疗研究。2019年,在JNCI上发表了第一篇关于其在临床前研究结果。在动物实验模型中发现CLDN18.2 CAR-T细胞具有很好的抗肿瘤性,并且具有良好的安全性(图8)。

科济药业的CLDN18.2 CAR-T细胞产品的临床试验开始于2017年。2019年该产品首次在国际舞台ASCO上展示。在2021年的ESMO大会上,北京大学肿瘤医院沈琳院长团队分享了CLDN18.2 CAR-T细胞在消化道肿瘤中的疗效和安全性分析报告。此外,CLDN18.2 CAR-T细胞已经在FDA和EMA获得了“孤儿药”资格认定,在EMA获得了优先药物资格认定,在FDA获得了再生医学先进疗法的资格认定。该产品于2020年在中国和北美获得了IND批准并启动了Ib期临床试验,2022年也在中国启动了II期关键性临床试验,这也是CAR-T细胞在实体瘤治疗中第一个进入II期关键性临床试验的产品(图9)。

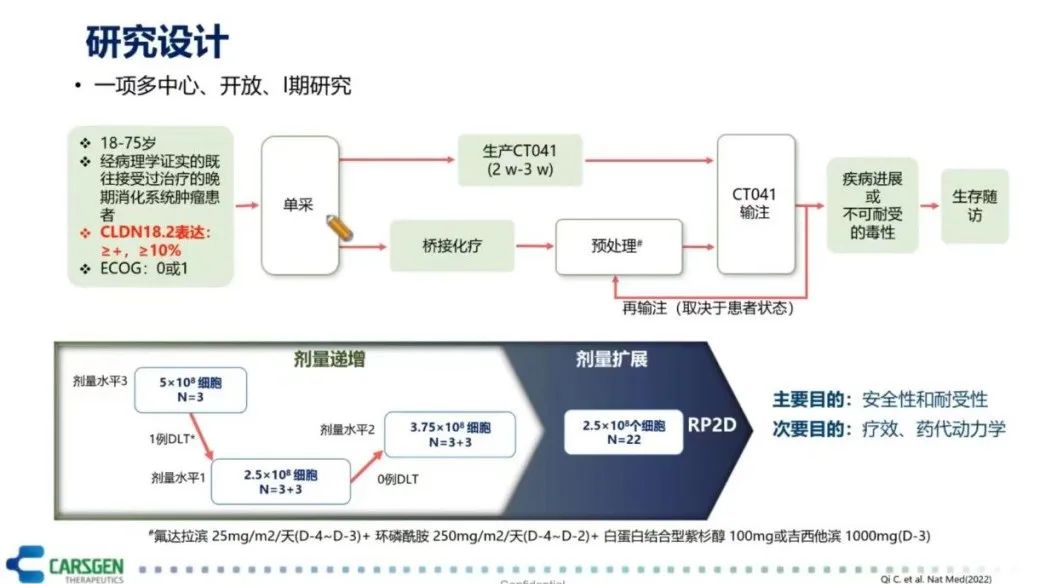
CLDN18.2在早期消化道肿瘤治疗的临床试验取得了积极的进展(图10)。这项临床试验入组的患者是CLDN18.2表达≥+或≥10%的阳性群体,这些消化道肿瘤患者主要是接受过两线或两线以上治疗失败的胃癌患者。这些患者经过单采、桥接化疗、清零预处理后接受CT041(CLDN18.2 CAR-T细胞)的治疗,给予了1-3个周期的治疗。这项临床试验是按照剂量递增和剂量扩展的方式进行了剂量设计。在剂量递增中做了3个剂量组,从2.5*10^8个细胞到5.0*10^8个细胞。II期临床研究推荐2.5*10^8个细胞作为使用的剂量。总的结果表明,CLDN18.2 CAR-T的总体耐受性良好。不良反应最常见的是血液学毒性,在10天内就能恢复,主要是清零导致的这类血液系统毒性不良反应。未观察到中毒性脑病(CRES)和≥3级以上的细胞因子风暴(CRS)。在疗效方面,18例既往至少2线治疗失败的GC/GEJ患者接受了CAR-T细胞治疗,其中40%患者既往接受过PD-(L)1单抗治疗,中位随访时间为7.6个月,ORR达到了61.1%(DCR为83.3%)。
04
结合临床需求,开展细胞治疗临床试验
有很多人可能困惑于细胞治疗中研究者发起的临床研究(IIT)和IND研究之间的区别和不同的考量点。实际上,细胞治疗正式纳入监管的轨道是从2017年12月开始的。CDE发布的《免疫细胞治疗产品研究与评价技术指导原则》正式规范了细胞免疫治疗的发展。后续,我们也看到一系列针对细胞治疗的指导原则不断出台(图11)。CDE非常关注细胞和基因治疗的发展,包括药学、非临床和临床研究等多方面都给出了一系列的指导原则。特别是在临床方面,除了这个临床试验的技术指导原则之外,还出台了CAR-T申报上市的指导原则以及长期随访的临床研究技术指导原则。同时,监管部门还有一些审评的考虑,这里就包含了关于研究者发起的临床研究,用于注册审评的几点思考,这样一些审评的考虑可供企业参考。

细胞和基因治疗需要一个全流程的监管(图12)。从临床试验的设计和实施开始,过程中间的风险控制以及质量控制,再到完成相关的临床试验之后进入到NDA申报。在NDA申报方面,细胞和基因治疗一些比较特别的地方,比如需要在特定的医疗机构进行评估和认证,并且要求选择的治疗中心需要配有完善的单采和回输操作规范。此外,在上市后应用方面,需要高度关注上市后研究和长期随访及治疗中心的管理。

2021年2月份颁布的《免疫细胞治疗产品临床试验技术指导原则(试行)》全文贯穿的宗旨是如何设计以临床价值为导向的药物开发临床试验,值得我们仔细研读。细胞治疗临床研究跟常规药品开发有很多不一样的地方,其中最重要的两个点:一是个体化,二是活细胞(图13)。所以需要我们充分的考虑细胞类型的多样性以及生物学性质的特殊性。另外,由于制备工艺复杂,可能会出现制备失败或延迟的现象,需要有预先相应的风险控制的措施。同时,还有运输和储备条件要求高。由于它的高度个体化制备规模有限,载体质控方面难度非常大。另外,给药方式复杂,需要清淋预处理,有时候还需考量桥接安全性风险的不确定性以及其他很多的因素。此外,由于细胞和基因治疗产品的属性,体内的长期作用可能增加不可预测的风险。为了评估和降低迟发性不良反应等风险,有必要进行长期随访(图13)。

除了中国发布的指导原则外,FDA在今年3月也颁布了一个CAR-T细胞的研发指南可供我们参考。该指南涵盖了研究人群、剂量选择、重复给药、间隔给药、制备延迟或失败、桥接治疗、PK/PD、免疫原性等多个维度的详细指导(图14)。该指南与国内的指导原则有很多相似和互补的地方,值得我们研究和借鉴。

CAR-T细胞治疗是前沿生物技术的集成者,因此CAR-T细胞治疗技术面临诸多问题和挑战,需要我们细胞治疗领域的同道们一起去应对。
小结
细胞治疗的出发点是基于患者的临床需求,以临床价值为导向;细胞治疗的落脚点在于回归患者群体,倾听患者声音。基于CDE的指导原则,从临床价值为导向这个角度去思考和设计细胞治疗的临床研究。学习传统药品开发的思路,从加强机制研究、提高精准化治疗、关注治疗需求的动态变化、不断改善药物的安全性、改善治疗体验和便利性、减少受试者负担等多个方面去考虑和设计细胞治疗的临床研究,为广大患者提供更优的治疗方案。
