染色体易位(8;21)是急性髓系白血病(AML)中最常见的遗传病变之一,重排后 AML1的DNA结合结构域与转录抑制因子ETO融合,导致AML1-ETO(AE)融合转录因子的表达。AE抑制正常AML1功能的转录活性,阻断其分化并促进了自我更新。常规化疗是AE阳性AML主要治疗方式,但常规化疗不能治愈,且大量患者容易复发。迄今为止,尚未找到针对白血病融合蛋白AML1-ETO药物靶点。
2022年2月德国格拉夫瓦尔德大学的Florian H. Heidel和和马克斯·普朗克生物化学研究所Matthias Mann等团队合作在Blood(IF 22.1)杂志上发表题为“PLCG1 is required for AML1-ETO leukemia stem cell self-renewal”的研究成果,利用DIA蛋白组学和转录组学发现由致癌融合蛋白AE驱动AML中磷脂酶C(PLC)信号通路发生变化,PLC家族中的PLC-gamma-1(PLCG1)鉴定为AE融合蛋白的特定靶标,确定PLCG1途径是AML1-ETO 白血病的重要治疗靶点。

研究材料
小鼠造血干细胞和祖细胞、AE阳性/阴性白血病患者CD34+细胞、AE-阳性SKNO1细胞、AE-阳性 Kasumi-1细胞
技术路线
· 步骤1:DIA蛋白组学分析小鼠AML1-ETO(AE)与MLL-AF9(MA9)诱导的AML白血病干细胞,确定差异蛋白;
· 步骤2:AE阳性/阴性白血病患者CD34+细胞蛋白组学验证差异蛋白变化情况;
· 步骤3:检测AML-1及转录因子与差异蛋白启动子区域的结合;
· 步骤4:检测差异蛋白对细胞功能的影响。
研究结果
1. 磷脂酶C信号在AML1-ETO LSCs中富集
首先,研究人员用表达AE或MLL-AF9的原代小鼠白血病干细胞进行了DIA蛋白质组学分析,共定量到3000多个蛋白,差异蛋白868个,功能分析发现磷脂酶C(PLC)通路和钙依赖性细胞信号通路显著上调。这一结果在原发性患者CD34+样本的蛋白组学分析中得到进一步证实。与文献已报道数据进行整合分析,发现在PLC家族中,只有PLCG1表达量在AE-AML中显著升高,而且PLCG1在复发患者中表达量也是显著升高。

图1 PLC和Ca2+信号在AML1-ETO转化的LSCs中富集
2. PLCG1是AML1-ETO的靶点
为了阐明AE-AML中PLCG1的高表达是否由AML1-ETO诱导,研究人员分析了AE-阳性SKNO1细胞、非AE细胞系(K562)和正常人CD34+细胞的AML1-染色质免疫共沉淀数据,发现只在AE-阳性SKNO1细胞的PLCG1启动子区域检测到与AML1特异性结合。AML1-ETO与不同的转录因子协同维持白血病细胞中PLGC1的高水平表达。研究人员进一步用多西环素(Dox)诱导的AML1-ETO人胚胎干细胞分化模型进行研究,发现PLCG1的表达与Dox同步且呈现Dox剂量依赖性。

图2 PLCG1是AML1-ETO的靶点
3. AML1-ETO与非编码元件的结合对PLCG1的表达至关重要
Chi-C实验确定了几个与PLCG1启动子区域结合的基因组区域,为更一步验证这些区域在AML1-ETO中的作用,研究人员采用CRISPR/Cas9技术,在AE-阳性 Kasumi-1和 SKNO-1细胞中,敲除PLCG1启动子-128kb区域的与AE结合的500bp基因片段,发现PLCG1的mRNA表达量下降。进一步添加抑制剂阻止RNA聚合酶II招募于增强子区域,也发现PLCG1的表达量显著降低。最后,研究人员采用CRISPR/ cas9敲除白血病活性所必须的转录因子,发现转录因子JUN、FOS和CREB的缺失将导致PLCG1 mRNA和蛋白表达量显著降低,ChIP-seq实验进一步发现AML1-ETO的缺失导致JUN与PLCG1启动子的结合减少。以上结果说明,AML1-ETO与信号响应因子AP-1和CREB是AE细胞中PLCG1高表达所必须的。

图3 AML1-ETO结合非编码元件影响PLCG1的表达
4. AML1-ETO诱导的细胞功能依赖于PLCG1
为评估PLCG1的功能重要性,研究人员在skno1细胞、Kasumi-1细胞中分别采用CRISPR/ cas9技术对PLCG1基因敲除或用RNAi对PLCG1基因敲低,发现细胞增殖能力下降,且PLCG1的基因失活导致诱导分化的骨髓标记物如CD13和CD14的表达增加。研究人员进一步对PLCG1缺失Kasumi-1细胞进行转录组分析,发现与骨髓分化相关的基因上调,与增殖、干细胞干性和c-Myc靶标相关的基因下调,此外,被AML1-ETO抑制的基因在PLCG1敲低后显著上调。这些结果表明,PLCG1缺失逆转了人类AML细胞中AML1-ETO融合引发的基因表达变化。
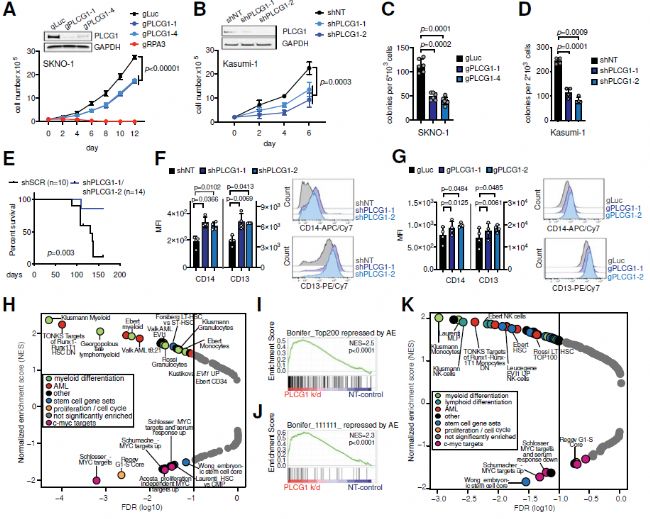
图4 AML1-ETO诱导的细胞功能依赖于PLCG1
5. AML1-ETO转化细胞依赖于PLCG1
为了解PLCG1在AE白血病干细胞(AE-LSCs)中的作用,研究人员选用与临床相关且侵袭表型更强的AML1-ETO9a (AE)和突变RAS (KRASG12D;K)(表示为AE/K)小鼠,建立了条件敲除小鼠模型。逆转录病毒表达导致Plcg1基因缺失,AE/K-LSCs (GFP+ LSK)细胞数目减少,并且AE诱导的体外无限增殖能力丧失。AE/K-LSCs中PLCG1的基因缺失也会损害次级受体宿主的白血病发展,然而在MLL-AF9 (MA9)转化的白血病干细胞中PLCG1的基因缺失对干细胞数目和再次接种能力无影响。以上结果说明,AML1-ETO转化的白血病干细胞生长依赖于PLCG1。

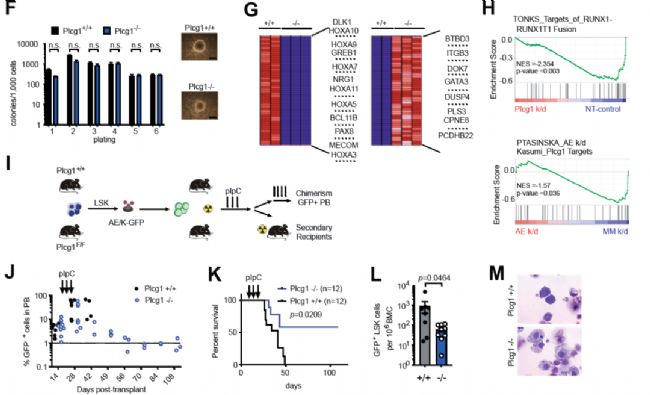

图5 AML1-ETO转化的造血干细胞依赖于PLCG1
6. PLCG1是维持AML1-ETO白血病干细胞所必需的
为了在体内证实以上推测,研究人员将亚致死剂量的AE/ k转化的Plcg1F/F Mx-Cre+和Plcg1+/+ Mx-Cre+白血病干细胞注射到受体宿主中,并在移植后的连续时间点监测,发现在注射pIpC诱导crec之前,两组白血病干细胞具有相似定植能力。注射pIpC后,每个受体小鼠的AE/K Plcg1+/+细胞总数增加,直到发生明显致命的白血病。Plcg1缺失导致受体宿主白血病发育丧失,白血病干细胞在外周血中数目下降,白血病干细胞出现分化诱导,细胞周期丧失,而对正常的造血干细胞无影响。连续注射5-氟尿嘧啶恢复造血功能,进一步证实只有AE驱动的AML白血病干细胞依赖于PLCG1维持自我更新能力。

图6 PLCG1维持白血病干细胞的功能
7. Ca2+信号的药理学干扰抑制AML1-ETO白血病干细胞的功能
到目前为止,还没有针对PLCG1的特异性抑制剂。为了评估AE转化细胞中依赖PLCG1的相关细胞功能,研究人员进行了深入的蛋白质组学分析,发现PLCG1缺失后412个蛋白显著下调。GSEA分析发现PLCG1缺失后,下游Ca2+-信号通路变化极明显。研究人员添加钙调神经磷酸酶抑制剂环孢素A(CsA)后,发现AE阳性细胞增殖能力显著降低,AE阳性白血病小鼠体内白血病症状减轻,导致二次受体宿主的疾病发病延迟,生存期延长,同时对AE阴性的MA9白血病小鼠无影响。此外CsA处理后,白血病干细胞数目减少,原代AE阳性AML细胞集落减少,而在正常造血干细胞中无影响。说明,靶向Ca2+-信号的药物CsA,可以干扰AE驱动的白血病干细胞,进而影响AE-AML的发展与维持。

图7 Ca2+-信号转导影响AML1-ETO白血病干细胞的体内外功能
本研究通过蛋白组学技术深入解析AML1-ETO型白血病的发病机理,发现PLCG1蛋白表达显著变化。后续研究中发现在小鼠和人AML中PLCG1的基因失活抑制了AML1-ETO依赖的自我更新程序、白血病增殖和体内白血病维持。这些结果表明PLCG1通路可作为AML1-ETO阳性白血病干细胞的一个重要治疗靶标。本研究为白血病临床治疗指出了新的方向。
中科优品推荐
目前DIA技术的应用越来越广泛,【中科新生命】在常规样本和特殊样本的DIA大队列检测方面均已积累了丰富的经验,是您值得信赖的优质DIA平台。欢迎老师前来咨询。