整合多组学策略的进展,如蛋白质组学和磷酸化蛋白质组学结合基因组学研究,已经推动了多种不同肿瘤的治疗发展。近期,国家神经疾病医学中心、复旦大学附属华山医院神经外科赵曜教授团队和复旦大学表型组研究员、生命科学学院丁琛教授团队对200例垂体腺瘤组织和7例对照样本进行了多组学(基因组、转录组、蛋白质组和磷酸化蛋白质组)检测和分析,以揭示垂体腺瘤的蛋白基因组学特征,并基于组学结果进行疾病分子分型,为将来的垂体腺瘤的精准治疗提供理论依据。研究成果以“Integrated proteogenomic characterization across major histological types of pituitary neuroendocrine tumors”为题,发表在Cell Research(IF:46.297)上。

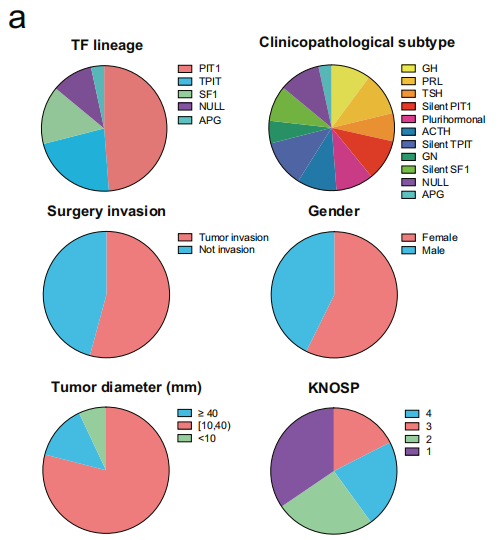
多组学样本分组设置及临床特征:
基因组全外显子测序:200例垂体腺瘤组织;
转录组RNA测序:194例垂体腺瘤组织+7例垂体前叶组织;
蛋白质组:200例垂体腺瘤组织+7例垂体前叶组织;
磷酸化蛋白质组:194例垂体腺瘤组织+7例垂体前叶组织;
垂体腺瘤患者的多种TF谱系、病理亚型及其他临床特征如下:
01
垂体腺瘤(PitNET)蛋白基因组图景概览
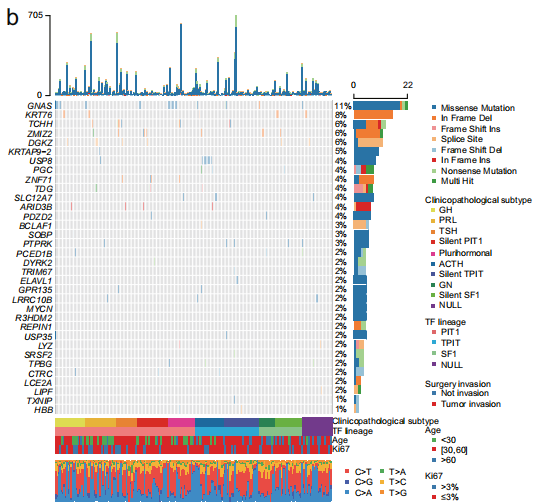
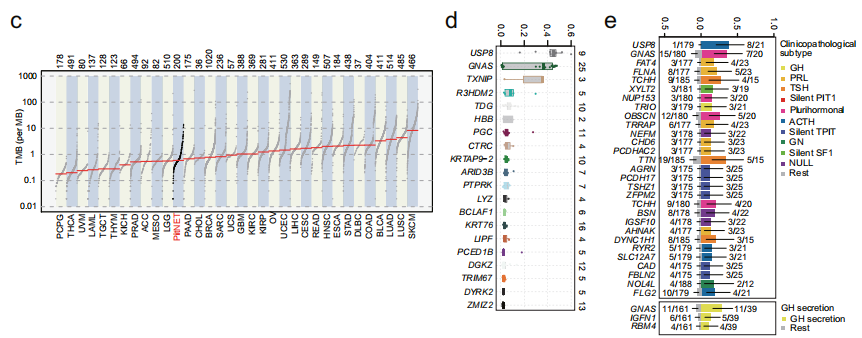
全外显子测序(WES)检测到了7333个突变基因,包括11092个非沉默点突变和419个小插入或缺失。研究者发现了多个和PitNET功能相关的显著性突变基因(SMG),包括GNAS (11%)、KRT76 (8%)、TCHH (6%)、ZMIZ2 (6%)、DGKZ (6%)、KRTAP9-2 (5%)和USP8 (4%)。对体细胞碱基改变分析显示,与其他五种替代类型相比,PitNET患者携带的C→A转变的比例较高。与TCGA数据库中的其他肿瘤相比,PitNET的肿瘤突变负荷(TMB)在33种癌症类型中处于较低或中等水平。随后,研究者比较了显著性突变基因(SMG)的变异等位基因频率(VAF),发现USP8突变(中位数:0.45)排在第一位,其次是GNAS突变(中位数:0.36)。紧接着,研究者对突变在各PitNET亚型中的富集情况进行分析,结果显示USP8突变在ACTH亚型中富集,而GNAS突变在多激素亚型和GH亚型中富集。体细胞CNA(拷贝数改变)分析发现染色体臂级别的扩增(Chr 5、7、8、9、12q、14q、19、20、21p)和缺失(Chr 1p、2q、11)。
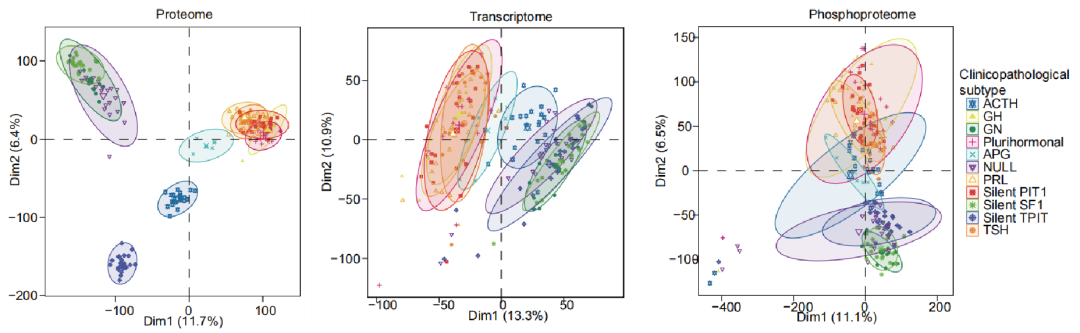
转录组RNA测序检测到了18397个基因(FPKM>1)。蛋白质组检测到了10011个蛋白,其中至少在一种肿瘤亚型的50%样本中被检测到的6160个蛋白进入下游分析。磷酸化蛋白质组检测到了5483个蛋白上的29219个磷酸化位点,其中至少在一种肿瘤亚型的50%样本中被检测到的9905个磷酸化位点进入下游分析。各组学的PCA分析显示,在蛋白质组学上,PIT1谱系(GH、PRL、TSH、silent PIT1和多激素腺瘤亚型)和APG、ACTH、silent TPIT及其他PitNET类型有明显区分。而转录组和磷酸化蛋白质组的PCA结果则显示,PIT1谱系肿瘤与APG组有更高的相似性。
02
基因改变对转录组、蛋白质组和磷酸化蛋白质组的影响
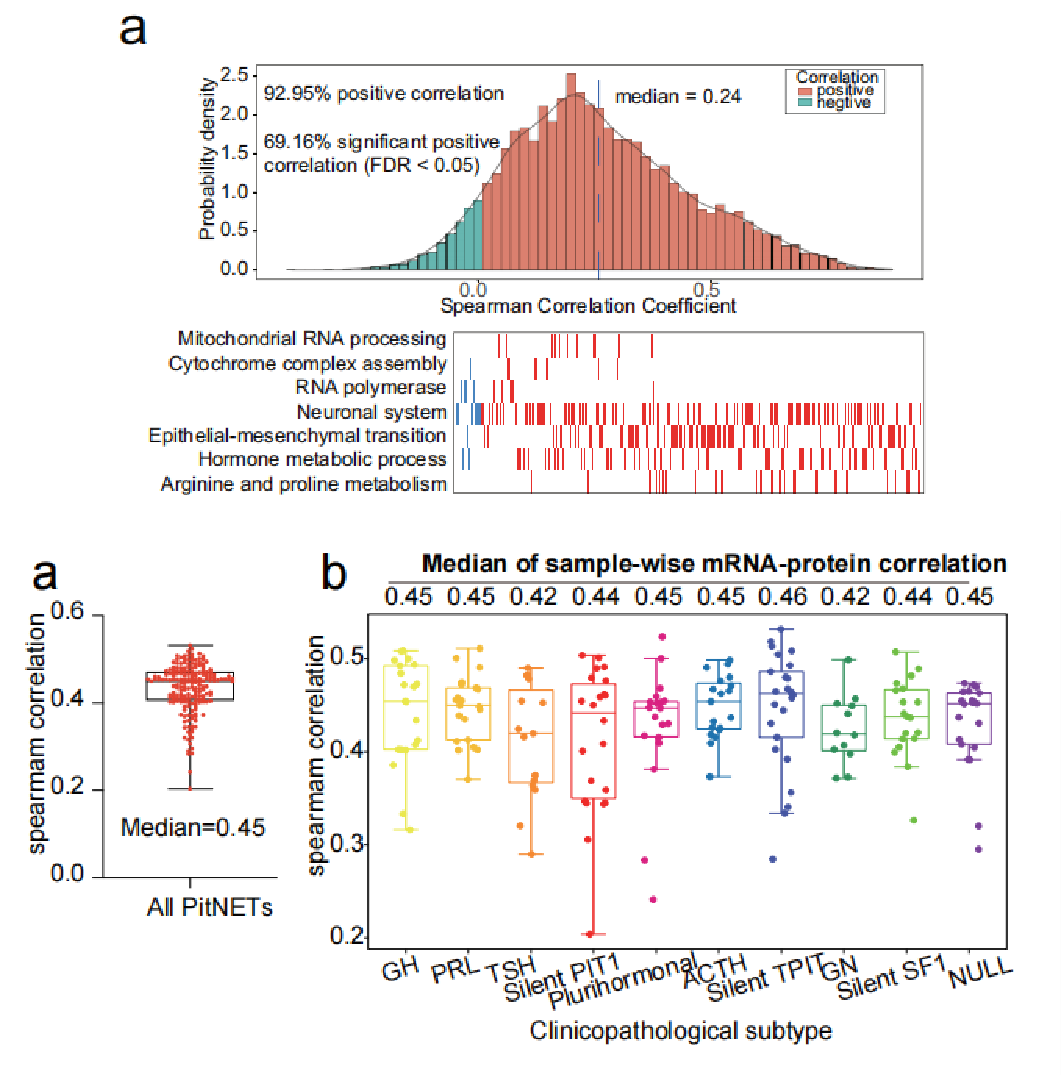
肿瘤组织转录组和蛋白质组的6115个mRNA-蛋白质对中的92.95%正相关。强相关基因富集在和神经系统、EMT、激素代谢过程相关的通路,表明这些通路在PitNET中过激活。总体样本层面上的mRNA-蛋白相关性中位值为0.45,各临床病理亚型样本的相关性从0.42-0.46。
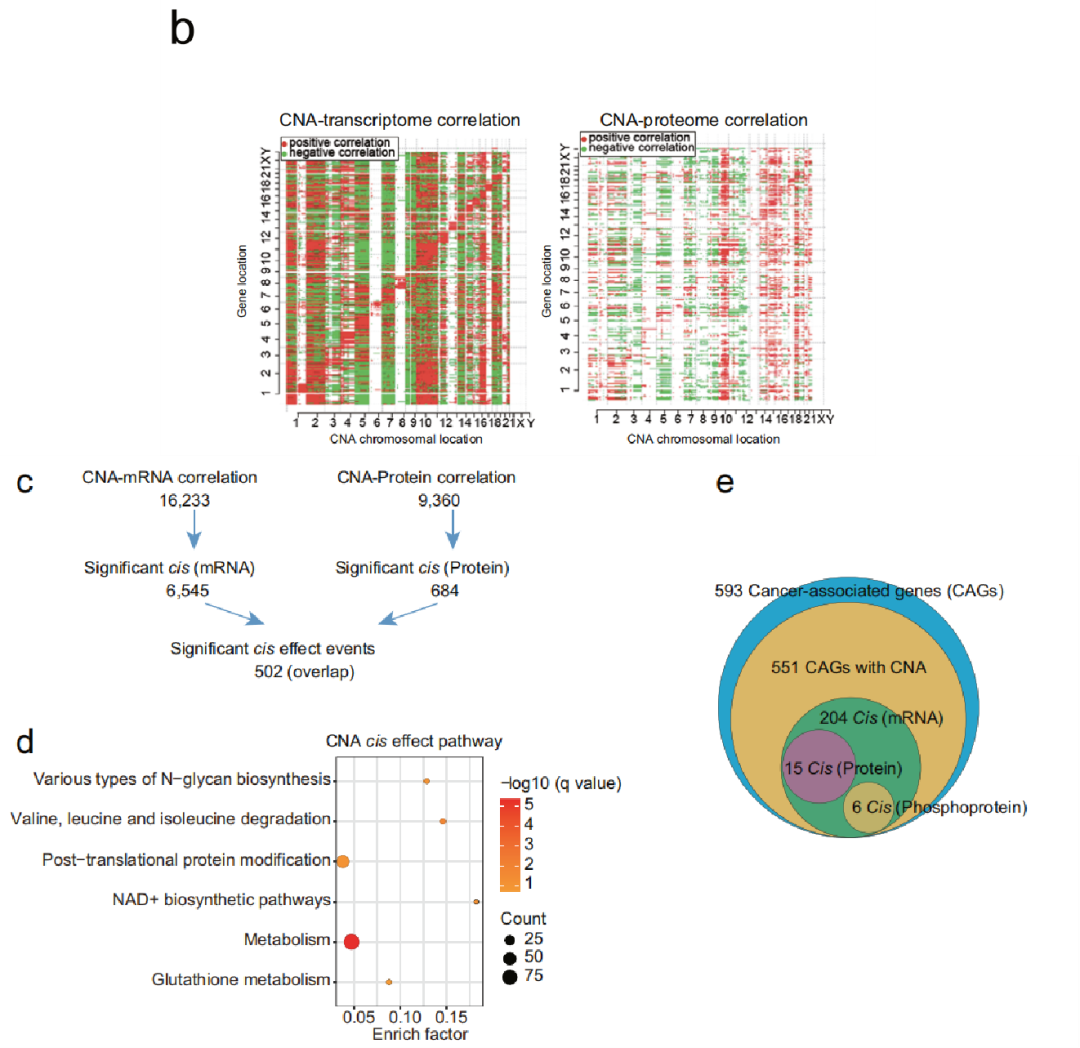
紧接着,研究者检测了23109个体细胞CNA对同基因座位(cis效应)和其他基因座位(trans效应)上mRNA、蛋白和磷酸化蛋白丰度的影响。Cis效应分析发现,CNA分别影响6545个mRNA表达丰度和684个蛋白质表达丰度,其中有502个显著性cis效应重合。这502个基因富集在蛋白翻译后修饰、NAD+合成和代谢通路。此外,研究者发现,CNA通过cis效应影响15个肿瘤相关基因(CAG)的mRNA和蛋白质表达丰度,CNA 通过cis效应影响6个CAG的mRNA和磷酸化蛋白质表达丰度。
03
PIT1谱系肿瘤中的GNAS突变和GNAS拷贝数增加
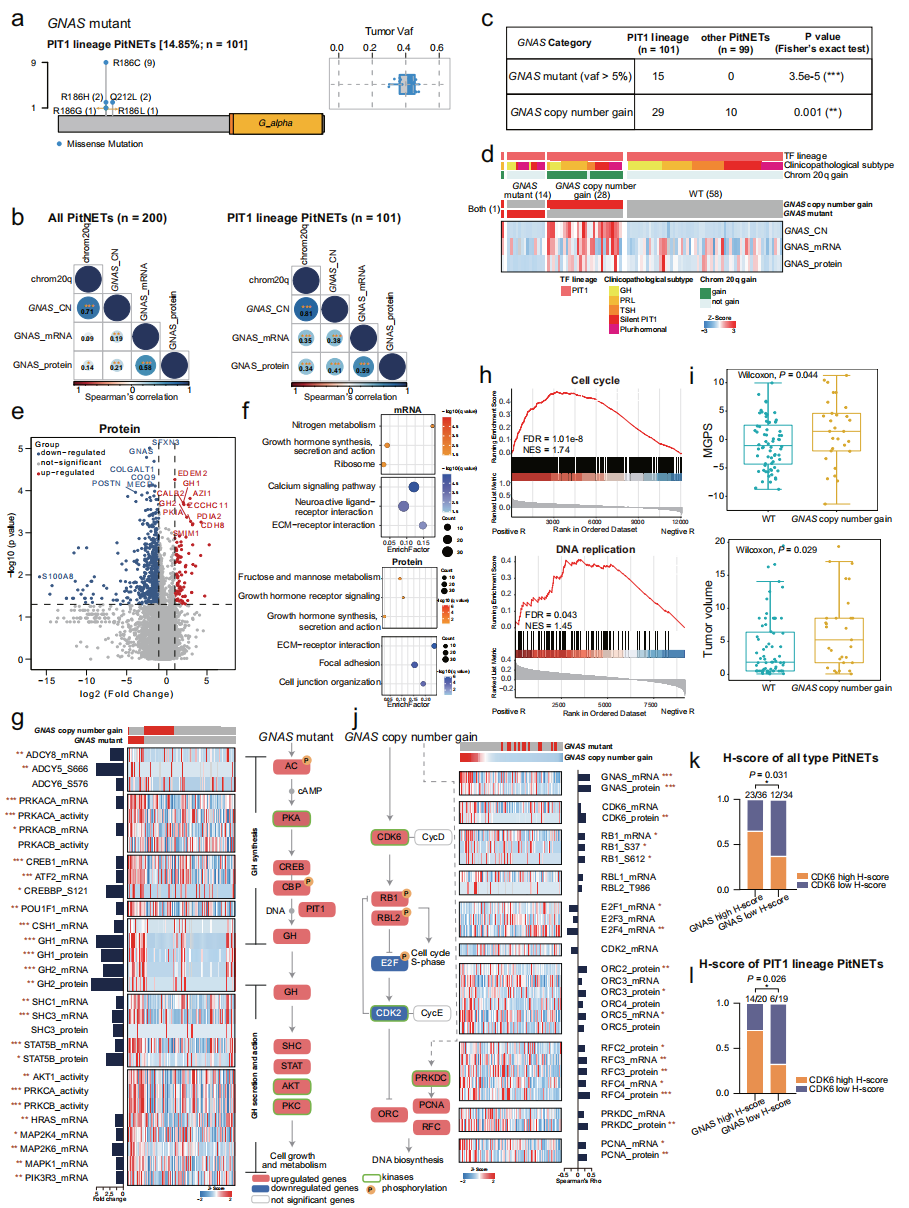
研究者的结果中,GNAS是PIT1谱系肿瘤中频率最高的基因突变,包含两个突变热点:R186C/G/L/H和Q212L。GNAS拷贝数增加,一个受到cis效应影响的肿瘤相关基因,对PIT1谱系肿瘤有重要影响。GNAS突变(VAF>5%)或GNAS拷贝数增加均富集在PIT1谱系肿瘤中。
通过整合全外显子数据,研究者将PIT1谱系肿瘤分为三个亚群:野生型(WT)、GNAS拷贝数增加和GNAS突变。与野生型相比,有GNAS突变的样本中,GNAS蛋白水平下调,而与GNAS拷贝数增加的样本中,GNAS mRNA和蛋白水平均上调。与WT相比,在GNAS突变亚群中,参与生长素合成、分泌和作用通路的基因在mRNA、蛋白和磷酸化水平均上调。与WT相比,GNAS拷贝数增加亚群有更高的多基因增殖得分(MGPS)和临床肿瘤体积。细胞周期相关分子中,PRKDC和CDK6是前两个与GNAS拷贝数增加正相关的分子。不管是在PIT1谱系肿瘤还是所有的PitNET中,高CDK6得分的样本占比在高GNAS拷贝数增加样本中比在低GNAS拷贝数增加的样本中更多。该结果提示我们,靶向CDK6的抑制剂也许是对含有GNAS拷贝数增加的PIT1谱系肿瘤有效的治疗策略。
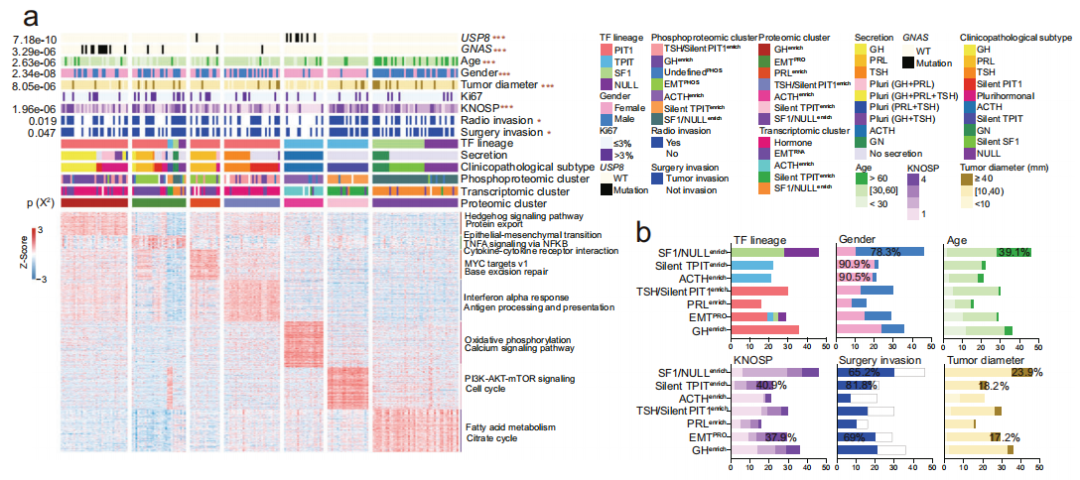
基于多组学结果的PitNET分子分型
基于蛋白质组、转录组和磷酸化蛋白质组的数据分别将PitNET分为7个、5个和7个疾病亚型。7个基于蛋白质组的疾病亚型为GHenrich、 EMTPRO、 PRLenrich、TSH/silent PIT1enrich、ACTHenrich、silent TPITenrich和SF1/NULLenrich。Hedgehog信号通路在GHenrich亚型中上调,MYC targets v1在PRLenrich亚型中上调。TSH/silent PIT1enrich中富集了干扰素α响应、抗原提呈通路。SF1/NULLenrich亚型中存在代谢相关通路的上调,如脂肪酸代谢和三羧酸循环。此外,在SF1/NULLenrich亚型中,有更多的男性、更高的患者年龄和更大的肿瘤直径。ACTHenrich亚型富集了USP8突变,ACTHenrich亚型和silent TPITenrich亚型都有更高比例的女性患者。
05
前三大TF谱系垂体腺瘤的分子特征分析
本研究中,垂体腺瘤按TF谱系分类,患者占比前三的分别是PIT1谱系、TPIT谱系和SF1谱系,总计占比超过75%。因此,研究者对这三类垂体腺瘤中的分子特征进行了分析。
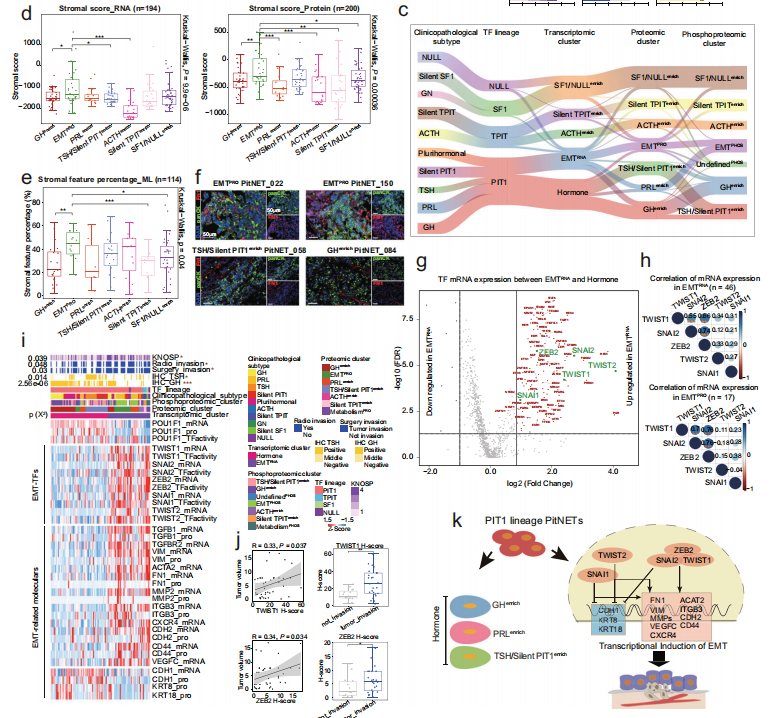
(1)在PIT1谱系肿瘤中发现了以EMT(上皮间质转化)为特征的侵袭亚型
与其他基于蛋白质组的疾病亚型相比,在EMTPRO亚型中存在与稳态及EMT相关分子包括GP1BB、FGB、MMP8、FN1和ITGB3的高表达。EMTPRO亚型是高侵袭性的,且肿瘤直径大。鉴于EMT在肿瘤转移中不可忽视的作用,研究者利用转录组和蛋白质组数据分析了基质细胞在其中的贡献。结果表明,不管是RNA还是蛋白质的分析结果都表明,EMTPRO亚型都有更高的基质细胞分值,该结果得到HE染色的验证。上皮marker pan-cytokeratin和间质marker FN1的免疫荧光共染色表明,在EMTPRO亚型中有更高比例的染色面积。以上这些结果表明,EMTPRO亚型中的肿瘤细胞呈现为EMT状态。
EMT-inducing transcription factor(EMT-TF)是EMT表型的重要驱动因子。研究者比较了PIT1谱系肿瘤中基于转录组分型的两个亚型间EMT-TF的表达情况,结果表明5个EMT-TF(SNAI1、SNAI2 、ZEB2 、TWIST1 和TWIST2)在EMTRNA亚型中显著上调。这5个EMT-TF的表达模式在EMTRNA和EMTPRO中高度正相关。
(2)在TPIT谱系肿瘤中发现3种EGFR激活模式
EGFR与多种癌症相关,且被提示可以作为ACTH PitNET的治疗靶点。研究者发现在TPIT谱系中,EGFR的mRNA表达、蛋白丰度和磷酸化修饰水平均比其他类型的肿瘤要高。通过分析EGFR相关通路,将TPIT谱系肿瘤分为3个亚群,分别为USP8突变的ACTH肿瘤、USP8未突变的ACTH肿瘤和silent TPIT肿瘤。在USP8未突变的ACTH肿瘤中,EGFR配体的mRNA显著上调。在silent TPIT肿瘤中,EGFR T693磷酸化显著富集。在TPIT谱系肿瘤中,EGFR表达更高,且EGFR T693磷酸化阳性率在silent TPIT肿瘤中高于ACTH肿瘤。此外,研究者还发现,4种转录因子可能参与了ACTH分泌和调控,或可作为新的治疗靶点。
(3)SF1谱系肿瘤和NULL肿瘤存在VEGF通路和缺氧信号的激活
多组学的疾病分型分析时发现,SF1谱系肿瘤和NULL肿瘤呈现出相似的表达模式,因此合并分型为SF1/NULLenrich亚型。肿瘤相关通路的富集分析显示,在SF1/NULLenrich亚型存在VEGF通路和缺氧信号的激活。进一步分析发现,不管是在mRNA、蛋白质还是磷酸化蛋白质水平,VEGF信号的下游信号,如RAS/RAF/MEK/ERK和PI3K-AKT信号均在SF1/NULLenrich亚型中激活。相比于其他PitNET肿瘤,VEGFR2的IHC染色结果也显示,其表达量在SF1谱系肿瘤和NULL肿瘤高表达。以上结果提示我们,靶向VEGFR2的治疗方案或许是这类病人的有效治疗手段。
06
PitNET的免疫浸润特征
研究者进一步使用xCell分析了肿瘤微环境中各种细胞的占比。一致性聚类分析共得到了4种具有独特免疫和基质特征的肿瘤类型:免疫耗竭型、CD4+T细胞浸润型、内皮细胞型和CD8+T细胞浸润型。CD8+T细胞浸润型包括ACTHenrich亚型和silentTPITenrich亚型,存在EGFR信号和细胞周期通路的上调。内皮细胞型存在CSF1R、CD34和PDL2 mRNA水平的上调及FGFR1蛋白水平的上调。CD4+T细胞浸润型中存在CTLA4的上调,提示我们此类肿瘤可能对免疫检查点相关治疗手段有响应。免疫耗竭型包括TSH/silent PIT1enrich和GHenrich蛋白亚型,存在高评分的Treg细胞和PDL1 mRNA的上调。PDL1 mRNA在TSH/silent PIT1enrich和GHenrich蛋白亚型中上调,提示我们可以尝试使用PDL1疗法。EMTPRO
上海吉凯基因医学科技股份有限公司 商家主页
地 址: 上海市浦东新区张江高科技园区爱迪生路332号
联系人:
电 话: 4006210302
传 真:
Email:service@genechem.com.cn
