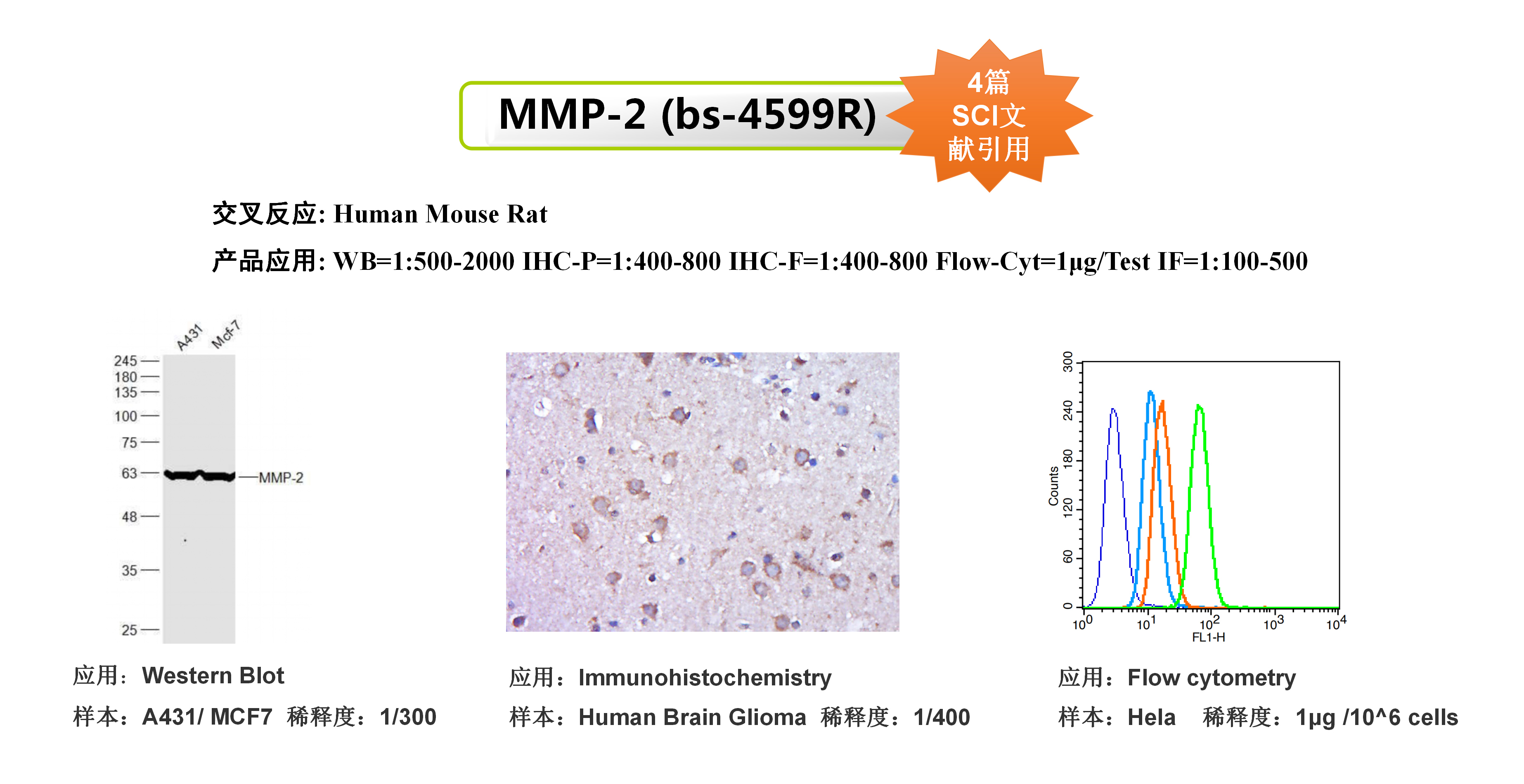
文章信息
期刊:Advanced Materials
影响因子(IF):21.950
文章名称:Tumor Microenvironment-Activatable Prodrug Vesicles for Nanoenabled Cancer Chemoimmunotherapy Combining Immunogenic Cell Death Induction and CD47 Blockade(点击获取全文)
作者:周方圆博士、冯兵博士
作者单位:中国科学院上海药物研究所药物研究国家重点实验室、药剂学中心
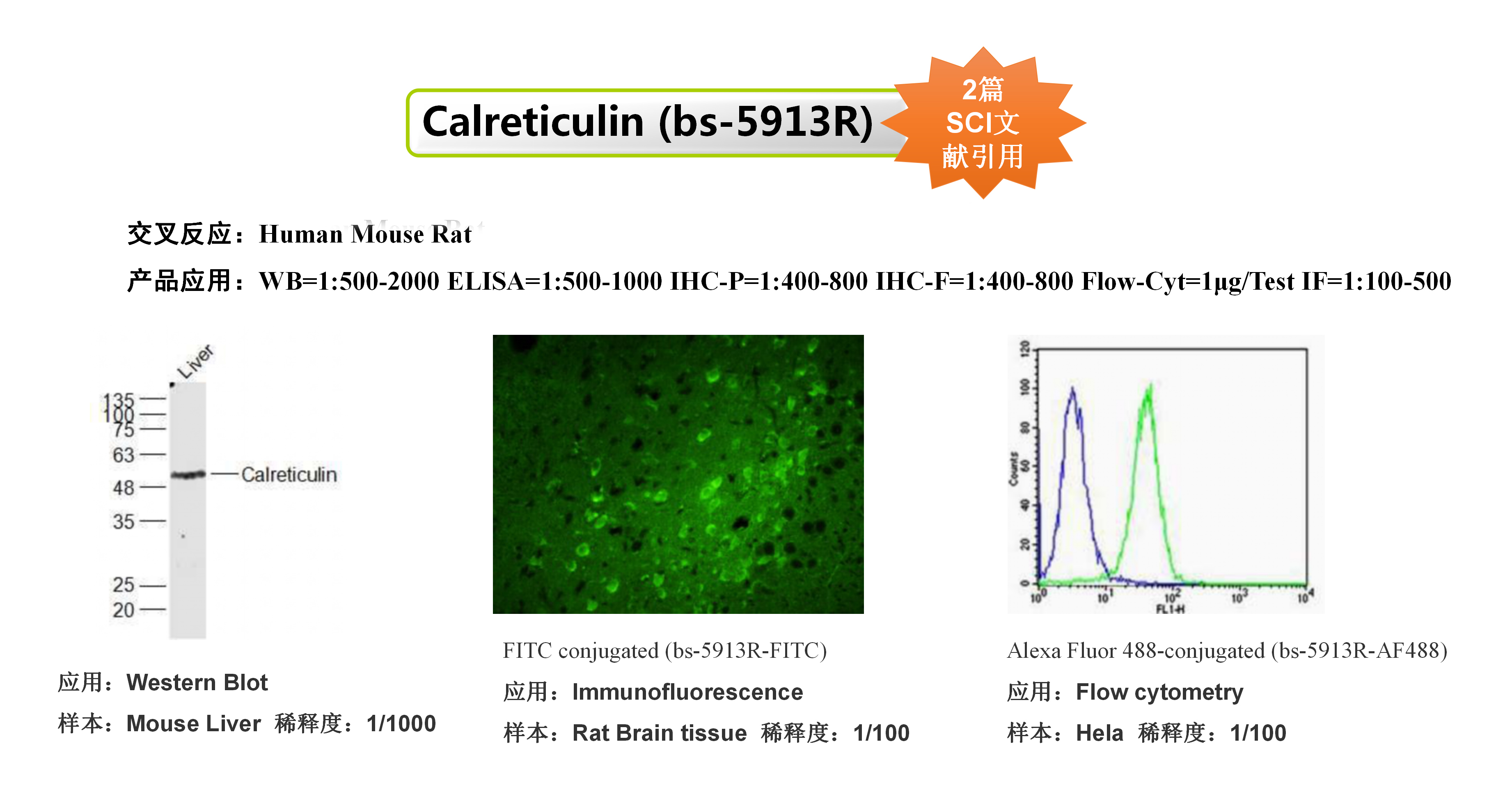
引用抗体:Anti-Calreticulin|bs-5913R
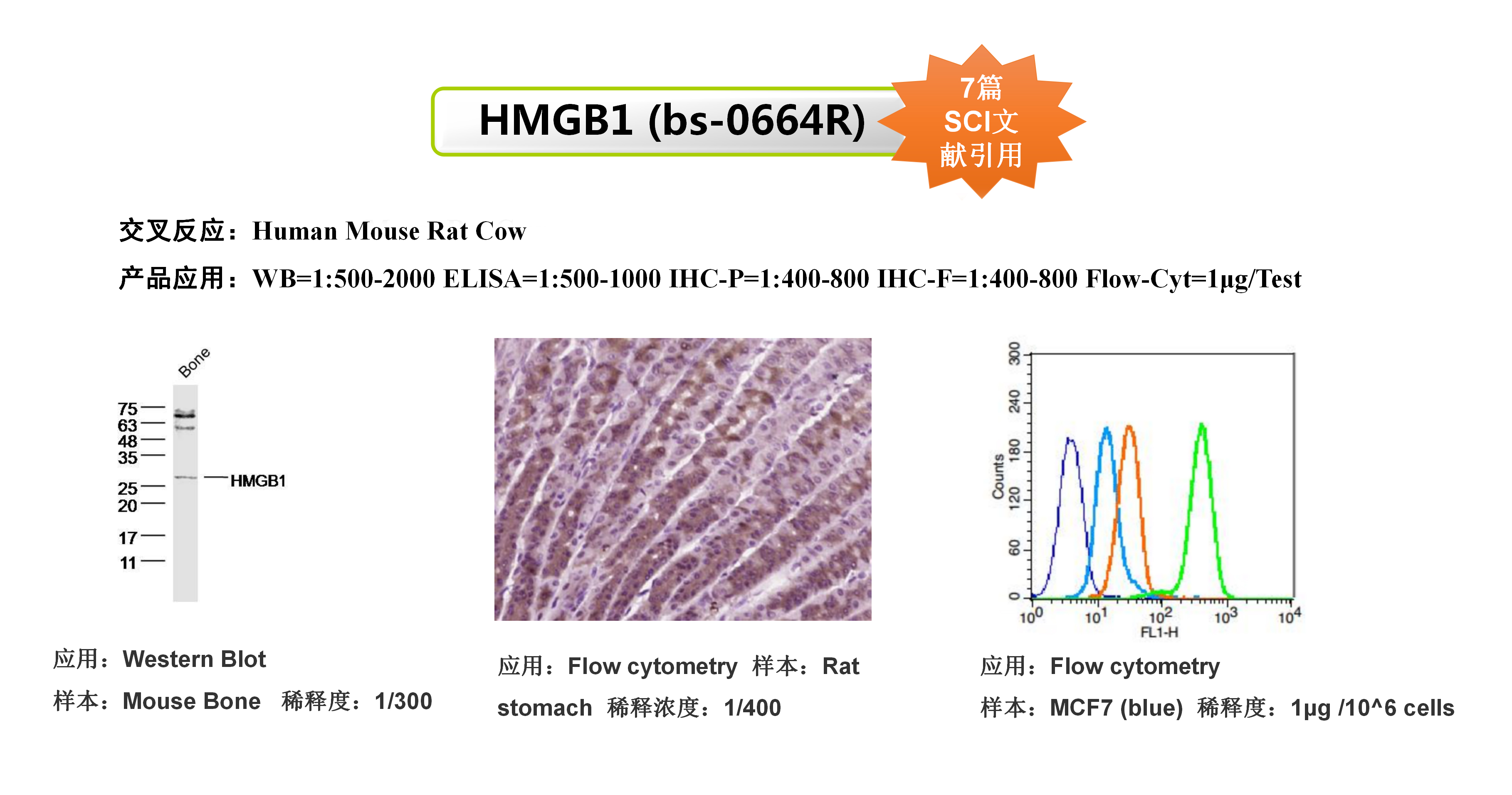
Anti-High mobility group protein 1(HMGB1)|bs-0664R
1. 研究背景
以PD-1/PD-L1抗体为代表的肿瘤免疫疗法为肿瘤治疗中带来一场革新,但是仍然面临着患者响应率低、单独治疗疗效不佳、会引起自身免疫性疾病等诸多挑战。患者自身肿瘤免疫原性较低使得肿瘤无法被机体的免疫系统所识别,导致肿瘤组织内免疫细胞浸润较少,这种免疫学上的“冷瘤”严重限制了抗肿瘤免疫治疗效果,因此如何增强肿瘤免疫原性来增加肿瘤抗原的识别和呈递,对激活抗肿瘤免疫应答和提高抗肿瘤免疫治疗效果至关重要。
2. 研究成果
该研究构建了一种肿瘤微环境响应的奥沙利铂前药脂质体MPV-HOAD,并协同CD47阻断,有效地增强了肿瘤的免疫原性和激活抗肿瘤免疫应答。他们发现:脂质体MPV-HOAD静脉给药后可以有效地靶向递送到肿瘤组织增加药物的递送效率。研究表明基于该脂质体的化疗-光动力治疗可以显著诱导肿瘤细胞发生免疫原性细胞死亡;脂质体诱导发生免疫原性细胞死亡协同CD47抗体治疗可显著增强肿瘤的免疫原性和诱导抗原呈递细胞的熟化从而激活抗肿瘤免疫应答,不仅抑制原位瘤的生长,在远端瘤也表现出很好的抑制效果。另外,经过脂质体MPV-HOAD协同CD47阻断治疗后的小鼠具备明显的抗肿瘤复发的能力。该工作首次利用奥铂前药纳米载药系统联合肿瘤免疫原性细胞死亡和CD47阻断,促进“吃我”信号CRT的外排和阻断“不要吃我”信号CD47免疫抑制蛋白,为增强肿瘤免疫原性和提高抗肿瘤免疫治疗提供新的方向和具备潜在的临床应用前景。
该研究使用了Bioss的CRT抗体和HMGB1抗体,用于研究肿瘤细胞膜上CRT的表达和HMGB1蛋白的外排以此来评价肿瘤细胞的免疫原性细胞死亡。
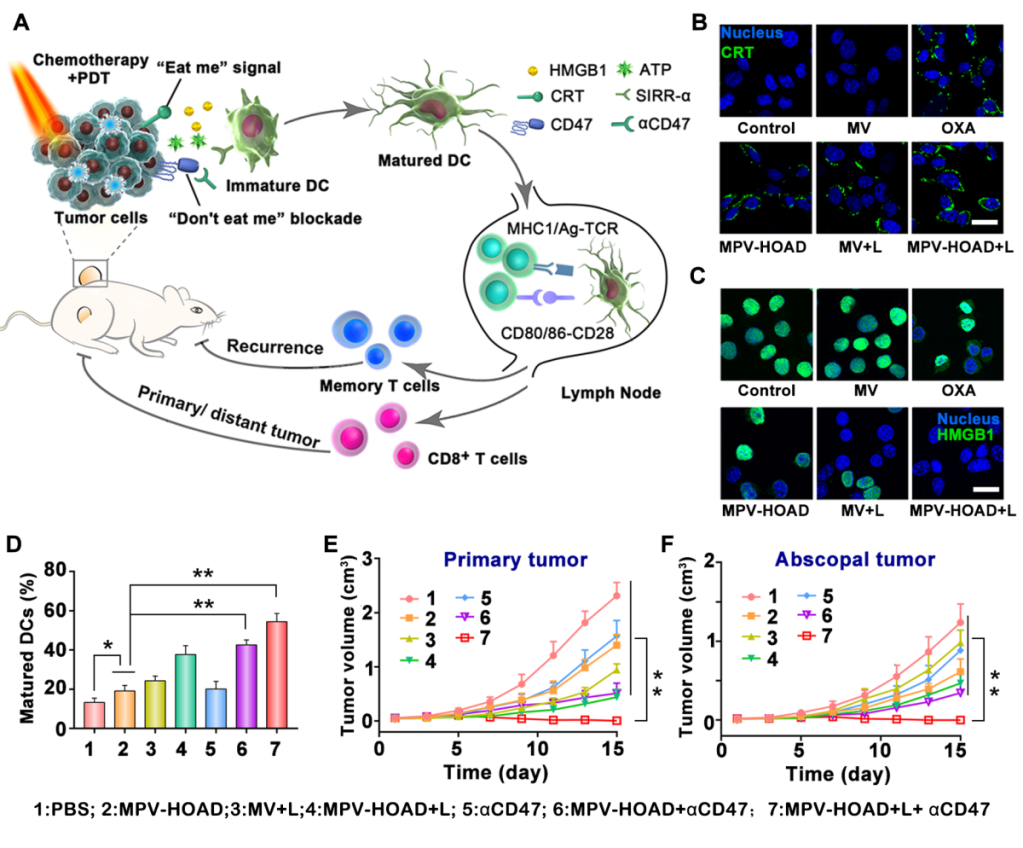
(A)奥沙利铂前药脂质体MPV-HOAD并协同CD47阻断抗肿瘤免疫治疗示意图;(B)MPV-HOAD脂质体诱导肿瘤细胞CRT外翻;(C)MPV-HOAD脂质体诱导肿瘤细胞HMGB1外排;(D)MPV-HOAD并协同CD47阻断诱导DC细胞熟化;(E)MPV-HOAD并协同CD47阻断抑制原位瘤的生长;(F)MPV-HOAD并协同CD47阻断抑制远端瘤的生长。
(感谢冯兵博士提供素材!)
※ Bioss 星推荐 ※