编者按
外泌体(exosome)是由大多数类型细胞分泌的直径为30~100nm的微小膜囊泡,广泛存在于各种体液(血液、尿液、乳汁等)及细胞培养上清中。外泌体携带了蛋白质、脂类、核酸(miRNA、mRNA)等多种物质,在局部微环境调节和细胞间通讯发挥了至关重要的作用。
外泌体被认为在肝癌(HCC)的发展进程中起了十分重要的作用。但外泌体调控HCC转移的分子机制并不明确。2021年4月HEPATOLOGY(IF 17.425)杂志发表了题为“M2 Macrophage–Derived Exosomes Facilitate HCC Metastasis by Transferring αMβ2 Integrin to Tumor Cells”的研究成果,该研究主要揭示了外泌体调控HCC迁移和肺转移的具体分子机制。研究结果表明M2 exos(M2巨噬细胞分泌的外泌体)上的整合蛋白CD11b/CD18通过上调MMP-9(基质金属蛋白酶9)诱导了HCC的迁移、侵袭和肺转移。中科新生命在本次研究中提供了外泌体蛋白组学服务。

M2 Macrophage‐Derived Exosomes Facilitate HCC Metastasis by Transferring αMβ2 Integrin to Tumor Cells
◆ 主要内容
1. CD206+TAMs与肝癌转移和预后相关
为了验证HCC转移与巨噬细胞相关,本研究使用癌旁组织、HCC癌组织、非转移HCC癌组织和转移癌组织检测巨噬细胞标志物的表达水平。免疫组化实验结果显示癌组织的CD68(巨噬细胞标志物)、CD206(TAM(M2巨噬细胞)标志物)水平明显高于癌旁组织(图1A-1D),转移HCC组织中的CD206水平也明显高于非转移HCC组织(图1E和1F)。
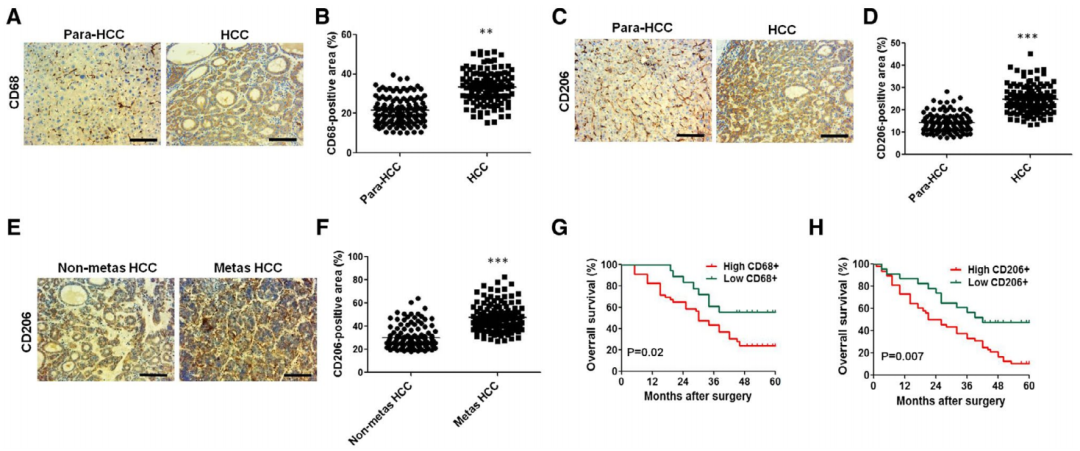
图1 巨噬细胞标志物在不同组织中的表达
2. CD206+ M2极化巨噬细胞通过分泌的外泌体促进肝癌细胞的迁移和侵袭
为了验证巨噬细胞的生物学功能,在体外实验使用THP-1单层细胞来模拟人巨噬细胞。M2-THP-1巨噬细胞与HepG2和Huh7(人肝癌细胞)共培养,结果证明M2巨噬细胞显著性增强了HepG2和Huh7细胞的迁移和侵袭潜能(图2A和2B)。HepG2和Huh7细胞使用M2极性巨噬细胞培养基培养,其迁移能力和侵袭能力也均有明显提高(图2C-2F)。上述实验证明M2极性巨噬细胞能激发肝癌细胞的迁移能力。
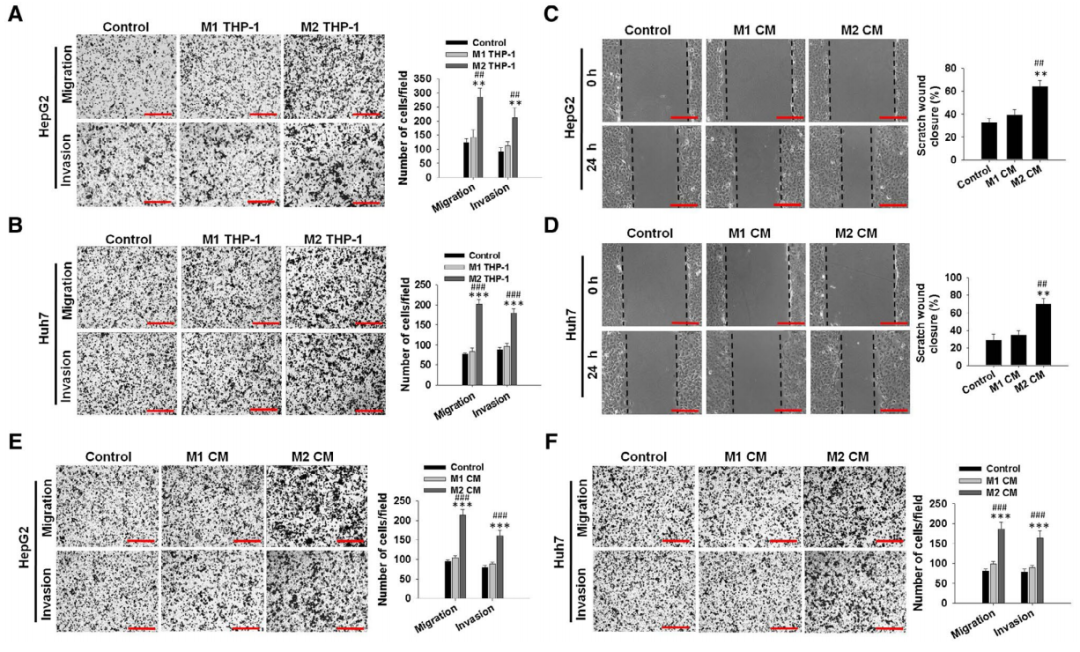
图2 M2巨噬细胞促进肝癌的转移
3.外泌体促进肝癌细胞的迁移和侵袭
为了验证外泌体在增强肝癌细胞迁移中发挥的作用,使用从M2巨噬细胞培养基中分离出的外泌体(图3A-3C)处理肝癌细胞,结果显示M2 exos显著提高了HepG2和Huh7细胞的迁移和侵袭能力(图3D-3G)。而在M2巨噬细胞培养基中加入GW4869(外泌体分泌抑制剂)做Transwell侵袭实验,发现M2 THP-1巨噬细胞不能促进HepG2和Huh7细胞的迁移和侵袭能力(图3H和3I)。体内实验也验证了M2 exos促进肝癌细胞的迁移和侵袭能力。M2 exos处理HepG2和Huh7细胞24hr后收集并注射入小鼠体内(图4A和4C)。三周后取肺组织,结果发现接种M2 exo处理的HepG2和Huh7细胞的小鼠的肺部转移灶明显增多,且总生存期也明显缩短(图4B和图4D)。
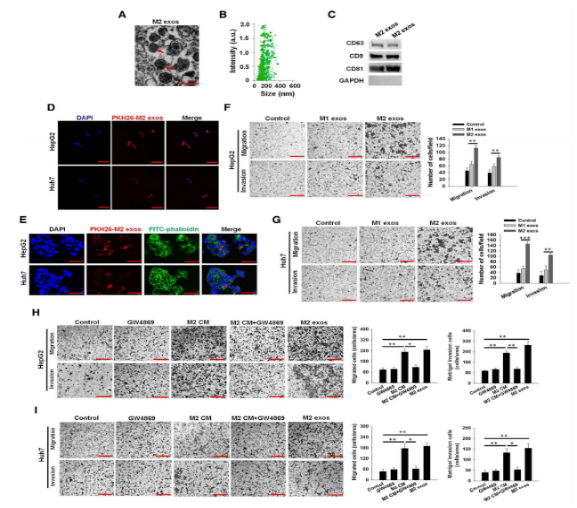
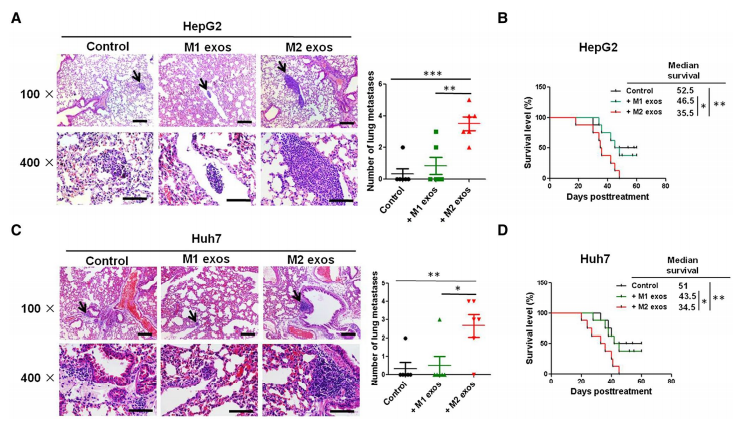
图3和图4 外泌体促进肝癌细胞迁移
4. 蛋白质组学筛选转移相关蛋白--CD18和CD11b
为了验证M2 exos上哪些蛋白介导肝癌细胞的转移,作者使用LC-MS/MS的方法进行M1及M2 exos外泌体蛋白质高通量筛选。通过组学实验筛选得到一系列差异表达蛋白,并选择了与免疫细胞功能相关的蛋白进行Western blot验证。通过验证实验发现CD18和CD11b在M2 exos中高表达(图5A和5B),且在M2 exos处理的HepG2和Huh7细胞中,CD11b/CD18与外泌体共定位(图5C和5D)且其蛋白水平也显著提高(图5E和5F)。
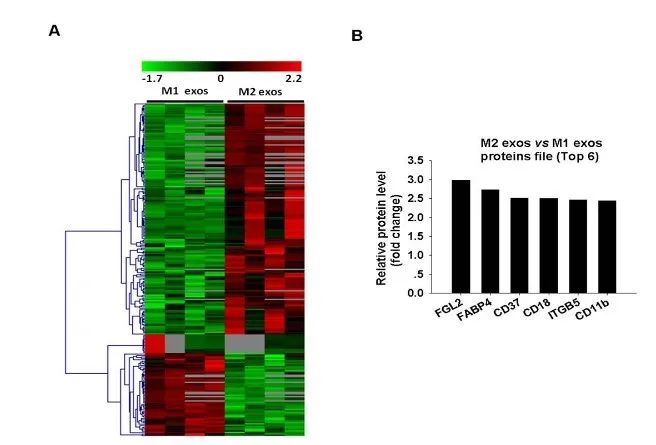
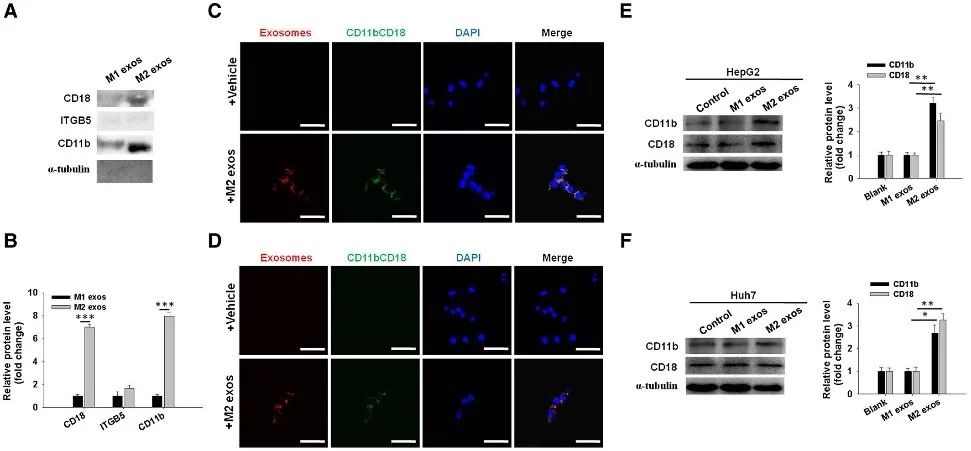
图5 外泌体蛋白质组学筛选及验证
5. CD11b/CD18 在肝癌转移中发挥重要作用
为了验证CD11b/CD18在肝癌细胞迁移中发挥的作用,作者在HepG2和Huh7细胞中加入M2 exos、CD11b和/或CD18阻断抗体开展transwell实验,结果表明加入阻断抗体后能明显抑制M2 exos处理的HepG2和Huh7细胞从上室转移至下室(图6A和6B)。体内实验也表明CD11b/CD18阻断抗体能显著抑制M2 exos诱导的HepG2和Huh7肿瘤肺转移(图6C和图6E),同时延长了小鼠寿命(图6D和图6F)。
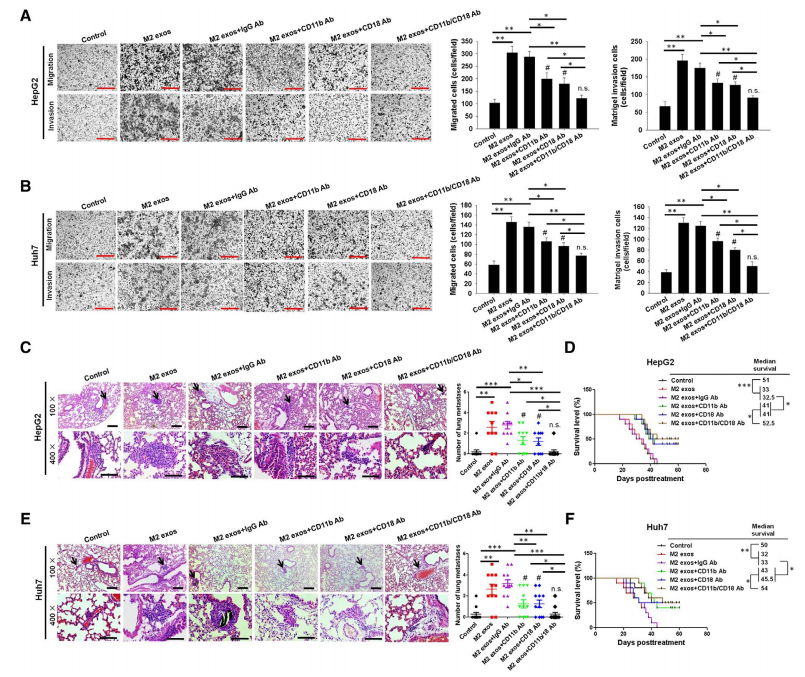
图6 外泌体功能蛋白验证
6. MMP-9介导M2 exos诱导的肝癌细胞迁移和肺转移
为了深入研究M2 exos的CD11b/CD18调控肝癌细胞迁移和侵袭的机制,本研究中使用定量PCR、WB、ELISA方法验证MMP-9(基质金属蛋白酶9)的表达。结果表明MMP-9在M2 exos处理的肝癌细胞中表达量上升、在加入CD11b/CD18阻断抗体后被显著抑制(图7A-7F)。在transwell实验(图8A)和伤口愈合实验(图8B和8C)中,加入CP471474(MMP-9抑制剂)与M2 exos处理的HepG2和Huh7细胞相比,肝癌细胞的迁移能力明显降低,肝癌细胞肺转移也明显降低(图8D)。
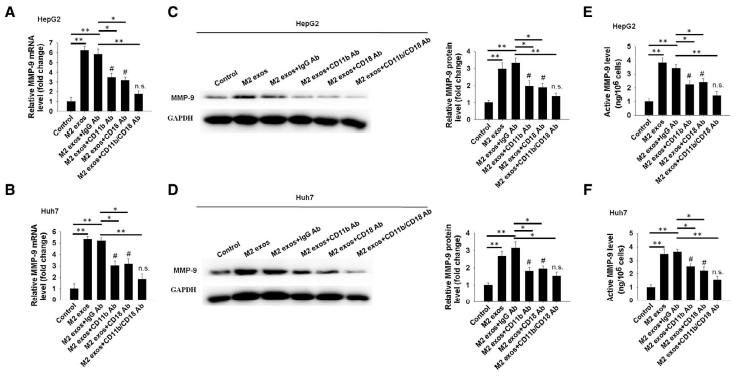
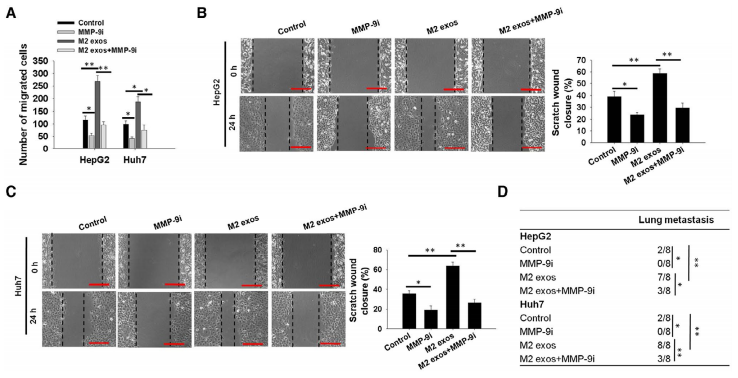
图7和图8 外泌体蛋白通过MMP-9介导肝癌细胞的迁移和肺转移
◆ 小结
外泌体在肿瘤的发生发展和转移过程中发挥了举足轻重的作用,该研究通过蛋白质组学的方法揭示了外泌体引起肝细胞癌(HCC)转移的具体作用分子机制,为HCC的诊断找到了新的靶点,为肿瘤转移的机制研究提供了新思路。
