
期刊:Advanced science
影响因子:14.1
伯豪技术服务+产品:转录组测序、单细胞转录组测序、伯优®单细胞测序组织保存液
研究背景
肿瘤微环境(TME)对癌症预后和疗效有重要影响,但其组成具有高度异质性,目前尚无一种普适性的高通量方法对其进行定义。本研究开发了TMEclassifier,一种机器学习工具,可将癌症分为三种不同亚型:免疫排斥型(IE)、免疫抑制型(IS)和免疫激活型(IA)。通过bulkRNA测序可根据TME亚型对患者样本进行分类,体内小鼠模型验证了TME亚型的差异以及对免疫治疗的不同响应。IE亚型的特征是基质细胞丰度高,与侵袭性癌症表型相关;IS亚型以髓系来源抑制细胞浸润为特点,加剧免疫抑制; IA亚型常与EBV(Epstein-Barr病毒)/MSI(微卫星不稳定)相关,表现出T细胞富集及更好的免疫治疗响应。本研究应用单细胞RNA测序探索TME的细胞异质性,体内实验表明,靶向IL-1(白细胞介素-1)可抵消IS亚型的免疫抑制作用,并显著提高其对免疫治疗的敏感性。TMEclassifier的预测在该前瞻性胃癌队列(TIMES-001)及其他多种队列中得到了验证。这种分类工具能够有效对患者进行分层,为个性化免疫治疗策略提供指导,从而提高治疗精准度。
主要技术
转录组测序、单细胞转录组测序、
伯优®单细胞测序组织保存液
(技术服务及科技产品由伯豪生物提供)
研究结果
1. TME亚型分类模型的构建与验证
作者基于亚洲癌症研究组(ACRG)胃癌队列的基因表达数据,通过CIBERSORT和MCP-counter工具估算23种肿瘤微环境(TME)细胞的浸润水平,经无监督聚类分析识别出三种稳定的TME亚型:免疫排斥型(IE)、免疫抑制型(IS)和免疫激活型(IA)。为实现高效且可重复的分类,作者通过成对差异表达基因(DEG)分析筛选出134个亚型特异性特征基因(IE:40个,IS:19个,IA:75个),并采用支持向量机(SVM)、随机森林(RF)、神经网络(NNET)等6种机器学习算法,在ACRG队列的训练集(75%样本)和验证集(25%样本)中构建集成模型(TMEclassifier)。结果显示,该模型在训练集的准确率达94%(Kappa值90%),验证集准确率82%(Kappa值74%),可稳定区分三种亚型。后续将其应用于1992例胃癌样本及多个癌症队列,结合bulk-seq和单细胞RNA-seq数据,进一步验证了该模型对TME特征、信号通路及细胞相互作用的区分能力,为后续分析奠定了可靠基础。
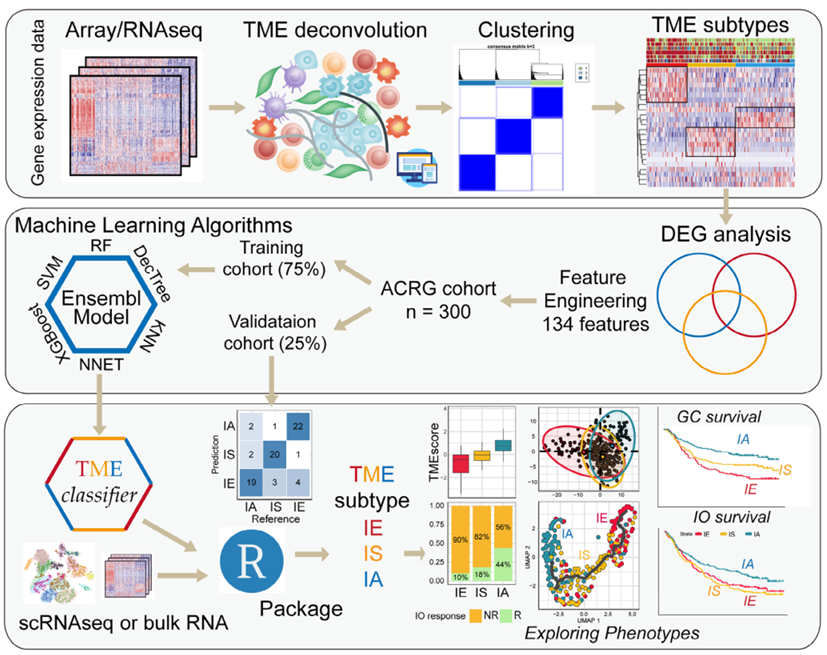
图1 TMEclassifier 构建和TME亚型特异性分析的工作流程
2. TME亚型与临床特征及生存结局的关联
在ACRG队列中,三种TME亚型呈现显著的临床和分子差异。临床特征方面,IE亚型多为晚期(AJCCIII/IV期占72%),以弥漫型Lauren分型为主(64%),且与上皮-间质转化(EMT)亚型高度相关;IA亚型多为早期(I/II期占59%),与微卫星不稳定(MSI)和EBV感染肿瘤(合计56%)高度相关。生存分析显示,IA亚型预后最佳,IE最差,IS居中,且该趋势在TCGA-STAD、GSE84437等多个队列中一致。辅助治疗(放化疗)可显著改善IE和IA患者的总生存期(p<0.001),但对IS患者无显著获益(p=0.25),提示IS存在固有耐药性。分子特征方面,IA亚型肿瘤突变负荷(TMB)最高,免疫检查点基因(如CD274、PDCD1)及效应CD8⁺T细胞功能基因(如CD8A、GZMB)表达显著上调,表现更强的抗肿瘤免疫活性;IE亚型TMB最低,在EMT和基质相关通路富集。免疫治疗响应方面,IA亚型TMEscore(反映免疫浸润水平)最高,对免疫检查点阻断(ICB)治疗的敏感性显著高于IE和IS,而传统标志物PD-L1CPS在该队列中无法有效区分治疗响应。
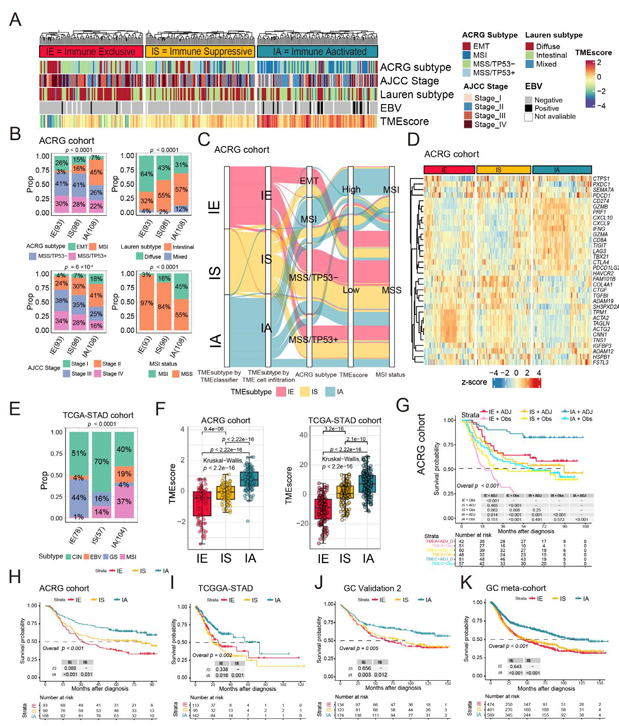
图2 TME亚型与临床特征、免疫治疗疗效生物标志物和生存结局的关系
3. TME亚型的细胞浸润模式及进化关系
通过bulk RNA和单细胞RNA-seq数据分析三种亚型的细胞浸润特征,结果显示三者之间有显著差异。IE亚型中癌症相关成纤维细胞(CAFs)、内皮细胞、M2型巨噬细胞及静息树突状细胞显著富集,形成“免疫排斥”微环境,阻碍免疫细胞浸润;IS亚型以中性粒细胞、M0型巨噬细胞、活化肥大细胞等髓系细胞浸润为主(髓系细胞占比21.97%),CD8⁺T细胞浸润最少,呈现“免疫抑制”表型;IA亚型高浸润CD8⁺T细胞、M1型巨噬细胞、活化记忆CD4⁺T细胞,具有强抗肿瘤活性,形成“免疫激活”微环境。单细胞数据进一步证实: IA中T-NK细胞富集(占比50.92%),髓系细胞在IS中占比最高,内皮细胞和成纤维细胞在IE中更活跃。拟时序分析提示三种亚型可能存在进化关系:从IA逐渐向IS、IE转化,为通过靶向干预逆转耐药微环境提供了理论基础。
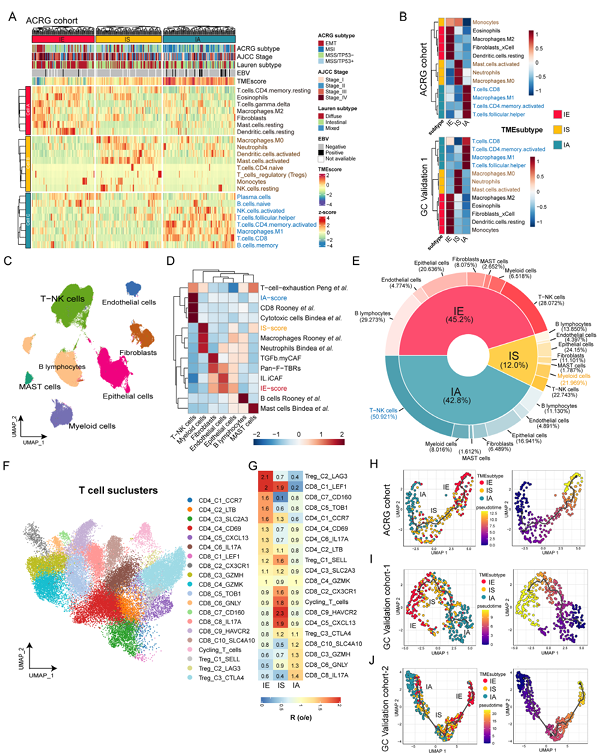
图3 三种TME亚型的肿瘤微环境景观和动态演化
4. IL-1/IL-1R1信号通路在IS亚型免疫抑制中的作用
机制研究发现,IS亚型中IL-1/IL-1R1信号通路上调是导致免疫抑制和ICB耐药的关键。表达特征上,IS亚型中IL-1α/β(配体)和IL-1R1(受体)表达显著升高,且与髓系来源抑制细胞(MDSC)浸润、T细胞耗竭呈正相关,与CD8⁺T细胞浸润呈负相关。细胞间通讯分析显示,IL-1/IL-1R1是IS亚型中最主要的配体-受体相互作用,通过招募髓系细胞和激活成纤维细胞,形成免疫抑制正反馈循环。动物实验验证:在IS亚型小鼠模型(YTN5细胞系)中,联合使用IL-1R抑制剂与抗PD-1抗体可显著增加CD8⁺T细胞和M1巨噬细胞浸润,激活细胞毒性T淋巴细胞分泌细胞因子,逆转ICB耐药,肿瘤杀伤效果提升约2倍。
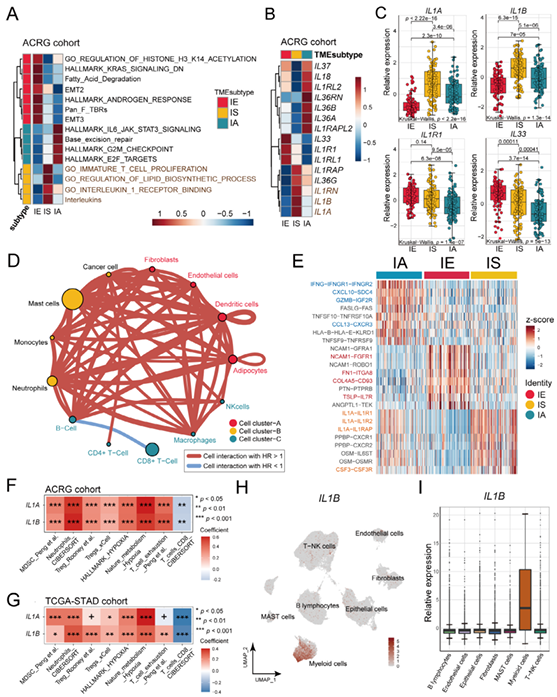
图4 TME亚型与IL-1/IL-1R1及其他生物学特征的关系
5. TME亚型作为跨癌种免疫治疗响应预测标志物的验证
在多个独立队列中,TMEclassifier的预测价值得到验证。胃癌队列中,TIMES-001前瞻性试验(n=93)显示,IA亚型患者接受ICB联合化疗的无进展生存期(PFS)显著长于IE/IS(p<0.001),且模型预测准确性(AUC=0.75)优于PD-L1CPS(AUC=0.63)和TIDE评分(AUC=0.58)。跨癌种验证中,在尿路上皮癌(IMvigor210队列)、肝细胞癌(GO30140+IMbrave150队列)和非小细胞肺癌(OAK+POPLAR队列)中,IA亚型均与更高的ICB响应率和更长的生存期相关,而IS亚型普遍对免疫治疗和化疗耐药。结合TMEclassifier与TMEscore(高TMEscore且为IA亚型的患者响应率达62.5%)可进一步提升预测准确性,为临床治疗决策提供更精准的依据,凸显了TME亚型分类在个性化免疫治疗中的重要价值。
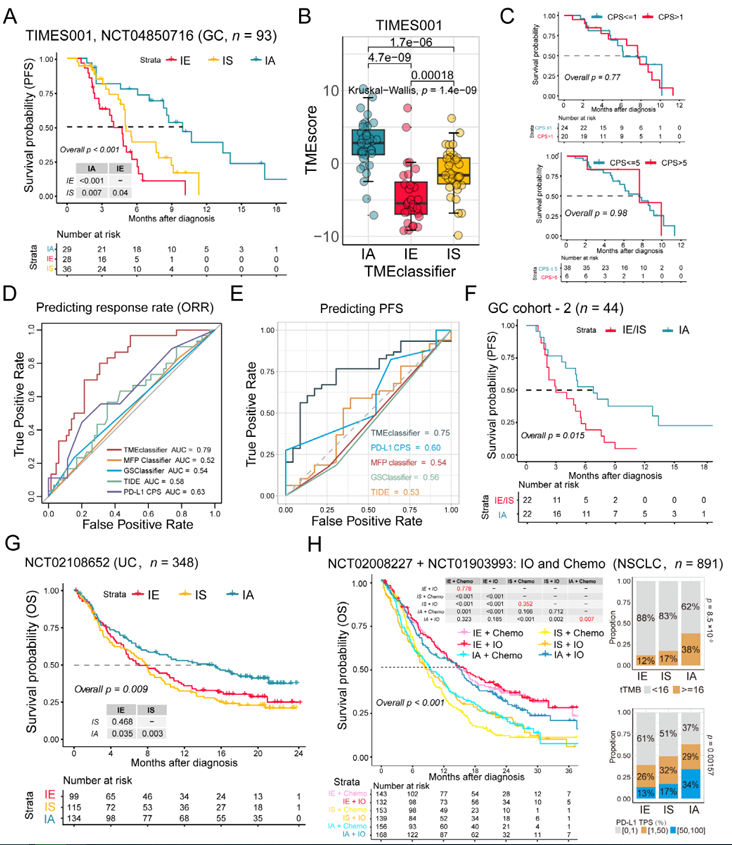
图5 TME分型作为胃癌和其他肿瘤类型免疫治疗响应预测生物标志物的验证
参考文献:
Zeng D, Yu Y, Qiu W, Ou Q, Mao Q, Jiang L, Wu J, Wu J, Luo H, Luo P, Gu W, Huang N, Zheng S, Li S, Lai Y, Huang X, Fang Y, Zhao Q, Zhou R, Sun H, Zhang W, Bin J, Liao Y, Yamamoto M, Tsukamoto T, Nomura S, Shi M and Liao W 2025 Immunotyping the Tumor Microenvironment Reveals Molecular Heterogeneity for Personalized Immunotherapy in Cancer Adv Sci (Weinh) 12 e2417593.
伯优®单细胞测序组织保存液专为人、小鼠等动物新鲜组织样本的保存和运输而设计。组织在4°C条件下保存72小时以内,可制备成高活率的细胞悬液,满足单细胞测序的实验要求。
